Tm - Tp - Compte Rendu Du Tp Extraction Liquide Liquide 6654.pdf
This document was uploaded by user and they confirmed that they have the permission to share it. If you are author or own the copyright of this book, please report to us by using this DMCA report form. Report DMCA
Overview
Download & View Tm - Tp - Compte Rendu Du Tp Extraction Liquide Liquide 6654.pdf as PDF for free.
More details
- Words: 2,677
- Pages: 12
Loading documents preview...
TP N°4: Extraction liquide-liquide Réalisé par :
om
" Transfert de matière "
.c
assisté par :
dz
un iv
Mr. Namane
2013/2014
But de la manipulation : Le but de cette manipulation est de déterminer la courbe de miscibilité d’un ternaire toluèneéthanol-eau.
** partie théorique ** Introduction : Principe de l’extraction liquide-liquide :
om
L’extraction liquide-liquide repose sur le transfert de solutés entre deux phases non totalement miscibles entre elles. L’extraction d’un soluté A à partir d’un mélange initial de A et de B nécessite l’introduction d’un solvant S qui extrait préférentiellement le constituant A de la solution considérée. Apres contact et séparation on obtient deux phases : l’extrait, phase riche en solvant chargé en soluté A transféré et le raffinat, solution de départ épuisée en soluté A. du point de vue des conditions d’emploi, l’extraction liquide-liquide fonctionne aisément à la pression atmosphérique et le plus souvent à la température ambiante (à l’exception d’opération entre métaux et sels métalliques fondus qui sont encore assez peu pratiqués).
•
•
Dans l’industrie pétrochimique, l’extraction liquide-liquide permet en effet de séparer des composés de températures d’ébullition voisines (hydrocarbures aliphatiques et benzéniques) grâce à leurs propriétés physico-chimiques différentes. La distillation, du fait des tensions de vapeur très voisines, exigerait un appareillage beaucoup plus important, donc plus couteux. Dans le cas de produits instables ou thermosensibles, tels la pénicilline, l’extraction liquide-liquide permet des séparations rapides qui ne dégradent pas thermiquement les produits considérés comme le ferai une distillation à température élevée. L’hydrométallurgie enfin est son domaine de prédilection : séparation de métaux en solution, traitement des combustibles nucléaires irradiés, concentration de solutions sans apport d’énergie trop important (contrairement à la distillation ou l’évaporation) 1.
dz
•
un iv
.c
Ce mode de séparation a deux domaines d’application principaux : la grande industrie chimique organique et la pharmacie d’une part, l’hydrométallurgie et l’industrie nucléaire d’autre part :
Pour que l’opération soit réalisable il est nécessaire : - que les deux phases ne soient pas complètement miscibles ; - que leur masse volumique soient différentes ; - qu’il n’existe pas de réactions chimiques entre les divers constituants du mélange.
1
J.P.MOULIN ; génie des procédés : école centrale paris. 1
Terminologie : - Soluté : constituant à extraire. - Diluant: liquide contenant les solutés. - Solution: ensemble soluté + diluant. - Solvant: liquide destiné à extraire les solutés. - Extrait : phase issue de l’opération contenant les solutés extraits. Cette phase est riche en solvant. - Raffinat : phase résiduelle épuisée en soluté. Cette phase est riche en diluant. - Phase lourde : phase ayant la plus grande masse volumique.
om
- Phase légère : phase ayant la plus faible masse volumique.
- Phase aqueuse/Phase organique : ces termes sont liés à la nature du solvant et du diluant.
un iv
Processus de l’extraction :
.c
- Phase continue/phase dispersée : le terme phase continue, utilisé lors de l’utilisation de colonnes d’extraction caractérise la phase de «remplissage de la colonne » au sein de laquelle l’autre phase dite dispersée se présente sous forme de gouttelettes.
L’extraction liquide/liquide est réalisée par le contact intime du solvant avec la solution dans des appareils destinés à mélanger les deux phases (ampoules, colonnes, mélangeurs). La séparation des phases s’obtient par décantation gravimétrique ou centrifuge.
dz
Le passage du soluté dans le solvant aboutit théoriquement à un équilibre dans la composition des phases. L’obtention de cet équilibre est liée à la vitesse de diffusion du soluté d’une phase à l’autre. Les vitesses d’extraction sont d’autant plus grandes que les différences de concentration en soluté des deux phases en contact sont grandes, et que la surface d’échange entre les deux phases est grande. L’agitation du milieu a pour effet d’augmenter la surface de contact entre les phases et de favoriser la diffusion du soluté au sein de chaque phase. La séparation ou décantation comprend la coalescence des fines gouttelettes de la phase dispersée en grosses gouttes, le regroupement de ces gouttes et leur rassemblement en une phase continue distincte de l’autre. Les émulsions stables, c’est à dire qui ne présentent pas de phénomène de coalescence sont à proscrire. La décantation sera d’autant plus rapide que l’on utilisera des liquides ayant des tensions superficielles élevées, ne donnant pas des gouttes trop petites (ordre du mm), dans une phase continue de faible viscosité. Des masses volumiques suffisamment éloignées favorisent l’opération.
2
Coefficient de partage ou de distribution : La distribution, ou le partage d’un soluté entre les deux phases à l’équilibre est donnée par le coefficient de partage (ou de distribution, ou de répartition). Cette grandeur se définit comme le rapport des teneurs respectives en soluté dans l’extrait et le raffinat lorsque l’équilibre est réalisé. Ce coefficient varie avec la nature des constituants en présence, leurs concentrations et la température. Il est peu influencé par la pression. Il est constant dans le cas de mélanges idéaux, constitués de molécules non associées pour lesquels la loi de Raoult s’applique et lorsque les deux liquides (diluant et solvant) sont parfaitement non miscibles. Dans ce cas la variation de y en fonction de x est une droite dont le coefficient directeur est le coefficient de partage.
om
Dans tous les autres cas on le détermine expérimentalement pour chaque équilibre et y = f(x) est représenté par une courbe appelée courbe de partage. Kc = y A / x A
.c
y A et x A sont les titres en soluté dans l’extrait et le raffinat.
Représentation graphique des mélanges ternaires :
un iv
Il y a plusieurs façons de représenter des mélanges à 3 constituants : diagramme triangulaire équilatéral, diagramme triangulaire rectangle, diagramme de distribution, diagramme de sélectivité, diagramme de Janecke. On utilisera le diagramme triangulaire équilatéral (solvant et diluant partiellement miscible).
dz
Le diagramme ternaire : C
% de B dans M
% de A dans M Isotherme de solubilité
Pc : Point critique tel que L, V, E, et R soient
M
E
- Conodale : caractérise l’équilibre entre E et R % de C dans M
- Isotherme de solubilité : A une T° donnée, on peut définir en tout point du diagramme les 2 zones Conodale suivantes :
R L
Chaque sommet représente un composé pur, chaque côté un binaire et chaque point un ternaire dont la composition se lit comme indiqué ci-contre.
A
B V
Zone de non miscibilité (2 phases) Zone de miscibilité (1phase)
3
Chaque sommet A, B, C est représentatif d’un des trois corps purs considérés. Chaque côté représente le mélange binaire des deux corps indiqués aux sommets correspondants. On peut sur chaque côté représenter la fraction (massique ou molaire) de l’un des deux corps. Nous raisonnerons sur les masses, tous les résultats obtenus par la suite seront, bien sûr, applicables au nombre de moles. Par exemple, sur le côté AB, on lira la teneur en B dans le sens A (0 %) vers B (100 %) ; la teneur en A se lira dans le sens opposé.
Sur la figure ci-contre, le point M est représentatif d’un mélange de A (40 %) et B (60 %). Dans le cas d’un mélange ternaire, tel celui représenté par le point M ’, on lit ses teneurs en A, B, C en projetant parallèlement aux côtés
om
BC, AC et AB respectivement. Ainsi M’est un mélange de A (70 %), B (10 %) et C (20 %).
.c
1) Relations barycentriques :
Soient deux points quelconques M 1 et M 2 situés dans le diagramme triangulaire : ils
un iv
représentent deux mélanges M1 et M2 de composition donnée ; si on note X Mi , Y Mi et Z Mi les fractions massiques en A, B et C du mélange Mi et Mi sa masse totale, la position du point M 3 qui représente le mélange de M1 et M2 est donnée par les bilans matière suivants : Masse totale : m 3 = m 1 + m 2
m3 XM 3 = m1 XM 1 + m2 XM 2
Masse de B :
m3 YM 3 = m1 YM 1 + m2 YM 2
Masse de C :
m 3 ZM 3 = m 1 ZM 1 + m 2 ZM 2
dz
Masse de A :
Ces relations traduisent le fait que le point M 3 est le barycentre des points M 1 et M 2 affectés de coefficients égaux aux masses totales des mélanges correspondants. Le point M 3 est donc situé sur la droite M 1 M 2 et sa position est donnée par la relation : 𝑴𝑴𝟑𝟑𝑴𝑴𝟏𝟏 𝐦𝐦𝟐𝟐 = 𝑴𝑴𝟑𝟑𝑴𝑴𝟐𝟐 𝐦𝐦𝟏𝟏 Avec M 3 M i longueur du segment. Si les trois composants d’un mélange sont
miscibles
en
toutes
proportions,
le
système
est
inutilisable en extraction liquide-liquide. Au contraire, les systèmes présentant deux phases liquides dans certaines zones de compositions ont de l’intérêt. Il en résulte sur leur diagramme triangulaire un domaine de
4
démixtion (ou zone de non-miscibilité) limité par une courbe appelée courbe binodale. Tout mélange M dont le point représentatif est à l’intérieur de ce domaine se sépare en deux phases liquides représentées par les points L et K situés sur la courbe binodale et de compositions différentes de celle de M. La phase K est ici plus riche en A que la phase L. La règle de la variance s’écrit dans ce cas, car température et pression sont fixées. Le nombre de constituants indépendants c est égal à 3 et le nombre de phase à 2. La variance v est alors égale à 1. Pour une phase saturée donnée, L par exemple, il existe une seule phase liquide K en équilibre avec elle. La droite LK est appelée droite de conjugaison. C’est une donnée expérimentale. Les deux parties de la courbe binodale représentent l’évolution des compositions des deux phases liquides saturées en équilibre. Divers types de domaines de démixtion peuvent exister selon
om
les propriétés physico-chimiques des trois mélanges binaires. Dans le cas de la figure cicontre, le domaine situé entre le sommet A et la courbe binodale est celui des solutions
.c
homogènes, car seuls les corps purs B et C sont non totalement miscibles.
2) Détermination des conodales :
un iv
C
Une fois l’isotherme de solubilité établie, on balaie la hauteur de la zone de non miscibilité avec des points figuratifs. On réalise les mélanges
dz
M
correspondant que l’on laisse décanter dans des ampoules puis on titre en soluté extrait et raffinat dont les points figuratifs (R&E) doivent être alignés avec le point figuratif du mélange initial M.
A
E
R B
5
** partie pratique ** 1) Matériel utilisé : • • • •
Burette Eprouvette Erlenmeyers Béchers
2) Produits utilisé : • • •
Ethanol Toluène Eau distillé
3) Mode opératoire :
dz
un iv
.c
om
Dans un premier temps on verse dans un bécher un volume bien déterminé du toluène à l’aide d’une éprouvette graduée, après on ajoute le volume correspond dans le tableau d’eau distillé, en suite on verse le mélange dans un erlenmeyer pour faire le dosage avec l’éthanol, l’équilibre atteint quand le mélange devient une seule phase, en fin on lit le volume d’éthanol ajouté. On peut assimiler ce mode opératoire par le schéma suivant
6
4) TABLEAU DE RESULTATS : échantillon
1
2
3
4
5
6
7
8
9
10
11
V eau
0 ,5
1
2
3
4
5
6
7
8
9
9.5
V toluène
9,5
9
8
7
6
5
4
3
2
1
0.5
V éthanol
1.8
8,0
9,3
14,5
15,6
18.5
16.5
15.5
12.5
11.0
9,4
5) Exploitation des résultats : 5-1) Les données du TP :
Masse volumique de
Masse volumique du
l’eau
toluène
l’éthanol
1 g.mL-1
0.87 g.mL-1
0.803 g.mL-1
.c
om
Masse volumique de
un iv
5-1-1) La masse des constituants et la masse totale : Le rapport massique de chaque constituant est calculé par : 𝑗𝑗=3
On a :
Avec
⍴i * Vi =mi
dz
Xi = [(⍴i * Vi) / ∑𝑗𝑗=1 ⍴𝑖𝑖 ∗ 𝑉𝑉𝑉𝑉 ]*100
Masse volumique =
𝐦𝐦𝐦𝐦𝐦𝐦𝐦𝐦𝐦𝐦 𝐝𝐝𝐝𝐝 𝐜𝐜𝐜𝐜𝐜𝐜𝐜𝐜𝐜𝐜𝐜𝐜𝐜𝐜𝐜𝐜𝐜𝐜𝐜𝐜𝐜𝐜 𝐯𝐯𝐯𝐯𝐯𝐯𝐯𝐯𝐯𝐯𝐯𝐯 𝐭𝐭𝐭𝐭𝐭𝐭𝐭𝐭𝐭𝐭𝐭𝐭
Masse du constituant = masse volumique × volume total 5-2) Calcul (exemple type) des différentes masses et le pourcentage massique: m toluène = ρ toluène × V toluène = 0.87 × 9.5 m toluène = 8.27 g m eau = ρ eau × V eau = 1 × 0.5 m eau = 0.5 g 7
m éthanol = ρ éthanol × V éthanol = 0.803 × 1.8 m éthanol = 1.45 g m total = m eau + m toluène + m éthanol = 0.5 + 8.27 + 1.45 m total = 10.22 g X eau = m eau / m total = 0.5 / 10.22 X eau = 0.05 X éthanol = m éthanol / m total = 1.45 / 10.21 X éthanol = 0.15
om
X toluène = m toluène / m total = 8.27 / 10.21 X toluène = 0.80
X
éthanol
1
3
4
5
1 7,83 6,42 15,25 0,06 0,52
2 6,96 7,47 16,43 0,12 0,43
3 6,09 11,64 20,73 0,15 0,29
4 5,22 12,53 21,75 0,18 0,24
0,42
0,45
0,56
0,58
un iv
0,5 8,27 1,45 10,21 0,05 0,80
2
dz
Echantillon m eau (g) m toluène (g) m éthanol (g) m tot (g) X eau X toluène
.c
On refait la même chose pour les autres on trouve :
0,15
Echantillon m eau (g) m toluène (g) m éthanol (g) m tot (g) X eau X toluène
6
7
8
9
10
11
5 4,35 14,86 25,20 0,2 0,18
6 3,48 13,25 22,73 0,27 0,15
7 2,61 12,45 22,05 0,32 0,12
8 1,74 10,03 19,78 0,40 0,1
9 0,87 8,84 18,70 0,48 0,047
9,5 0,44 7,55 17,48 0,54 0,03
X
0,59
0,58
0,56
0,50
0,49
0,43
éthanol
8
6) Représentation graphique : Voir le papier millimétrique.
7) Interprétation du graphe : La solubilité maximum de toluène dans l'eau n'est que de 0,05 g/100g. L'éthanol est totalement miscible avec l'eau et l'éthanol est totalement miscible avec le toluène. Toutefois, l'éthanol est partiellement miscible avec l'eau et le toluène. L'ajout d'éthanol à l'eau et le toluène va produire un schéma monophasé puisque tous les liquides sont miscibles. Dans ce cas, l'éthanol sert de substances polaires intermédiaires, il peut déplacer l'équilibre électronique de l'eau polaire et le toluène non polaire.
om
Sur la base des résultats obtenus, quand il y a un pourcentage plus élevé du toluène par rapport au pourcentage de l’eau, le volume de l’éthanol nécessaire pour titrer le mélange jusqu'à disparition des troubles est plus faible. La nébulosité n'apparaîtra que s’il y a existence
.c
de deux phases. Cela signifie que le pourcentage élevé d'éthanol augmente la miscibilité entre les trois composantes. Une seconde phase est uniquement séparée quand la proportion
un iv
d'éthanol ajoutée dépasse le pourcentage théorique dans lequel trois composants sont partiellement miscibles.
La courbe tracée sur le diagramme de phase triangulaire est généralement connue comme courbe binomiale. La zone délimitée par la courbe binomiale indique une région à deux
dz
phases tandis que la zone à l'extérieur de la courbe est la région monophasée 2.
2
Technique de l’ingénieur (Extraction liquide-liquide, Bases physico-chimiques des procédés) J2761. Gérard COTE.
9
10
om
.c
un iv
dz
Grace à cette manipulation nous avons pu dessiner le diagramme triangulaire équilatéral du ternaire eau-éthanol-toluène. Ce diagramme représente la courbe de miscibilité du ternaire précédant, tel qu’en dessus de cette courbe, on a un mélange homogène (l‘éthanol a solubilisé le toluène et l’eau et on observe une seule phase liquide et en dessous de cette courbe on a un mélange hétérogènes, on observe deux phases liquides. On peut dire, qu’à l’aide de ce TP, nous avons pu lier les phénomènes thermodynamiques avec ceux de transfert de matière à savoir la miscibilité partielle et l’extraction liquideliquide.
om
La technique d’extraction est très importante dans l’industrie et elle joue un rôle primordial dans le domaine de séparation.
dz
un iv
.c
Il faut mentionner qu’avec cette technique, on arrive jamais à extraction complète car on ne dispose pas d’un solvant qui permet la parfaite séparation des composés.
11
om
" Transfert de matière "
.c
assisté par :
dz
un iv
Mr. Namane
2013/2014
But de la manipulation : Le but de cette manipulation est de déterminer la courbe de miscibilité d’un ternaire toluèneéthanol-eau.
** partie théorique ** Introduction : Principe de l’extraction liquide-liquide :
om
L’extraction liquide-liquide repose sur le transfert de solutés entre deux phases non totalement miscibles entre elles. L’extraction d’un soluté A à partir d’un mélange initial de A et de B nécessite l’introduction d’un solvant S qui extrait préférentiellement le constituant A de la solution considérée. Apres contact et séparation on obtient deux phases : l’extrait, phase riche en solvant chargé en soluté A transféré et le raffinat, solution de départ épuisée en soluté A. du point de vue des conditions d’emploi, l’extraction liquide-liquide fonctionne aisément à la pression atmosphérique et le plus souvent à la température ambiante (à l’exception d’opération entre métaux et sels métalliques fondus qui sont encore assez peu pratiqués).
•
•
Dans l’industrie pétrochimique, l’extraction liquide-liquide permet en effet de séparer des composés de températures d’ébullition voisines (hydrocarbures aliphatiques et benzéniques) grâce à leurs propriétés physico-chimiques différentes. La distillation, du fait des tensions de vapeur très voisines, exigerait un appareillage beaucoup plus important, donc plus couteux. Dans le cas de produits instables ou thermosensibles, tels la pénicilline, l’extraction liquide-liquide permet des séparations rapides qui ne dégradent pas thermiquement les produits considérés comme le ferai une distillation à température élevée. L’hydrométallurgie enfin est son domaine de prédilection : séparation de métaux en solution, traitement des combustibles nucléaires irradiés, concentration de solutions sans apport d’énergie trop important (contrairement à la distillation ou l’évaporation) 1.
dz
•
un iv
.c
Ce mode de séparation a deux domaines d’application principaux : la grande industrie chimique organique et la pharmacie d’une part, l’hydrométallurgie et l’industrie nucléaire d’autre part :
Pour que l’opération soit réalisable il est nécessaire : - que les deux phases ne soient pas complètement miscibles ; - que leur masse volumique soient différentes ; - qu’il n’existe pas de réactions chimiques entre les divers constituants du mélange.
1
J.P.MOULIN ; génie des procédés : école centrale paris. 1
Terminologie : - Soluté : constituant à extraire. - Diluant: liquide contenant les solutés. - Solution: ensemble soluté + diluant. - Solvant: liquide destiné à extraire les solutés. - Extrait : phase issue de l’opération contenant les solutés extraits. Cette phase est riche en solvant. - Raffinat : phase résiduelle épuisée en soluté. Cette phase est riche en diluant. - Phase lourde : phase ayant la plus grande masse volumique.
om
- Phase légère : phase ayant la plus faible masse volumique.
- Phase aqueuse/Phase organique : ces termes sont liés à la nature du solvant et du diluant.
un iv
Processus de l’extraction :
.c
- Phase continue/phase dispersée : le terme phase continue, utilisé lors de l’utilisation de colonnes d’extraction caractérise la phase de «remplissage de la colonne » au sein de laquelle l’autre phase dite dispersée se présente sous forme de gouttelettes.
L’extraction liquide/liquide est réalisée par le contact intime du solvant avec la solution dans des appareils destinés à mélanger les deux phases (ampoules, colonnes, mélangeurs). La séparation des phases s’obtient par décantation gravimétrique ou centrifuge.
dz
Le passage du soluté dans le solvant aboutit théoriquement à un équilibre dans la composition des phases. L’obtention de cet équilibre est liée à la vitesse de diffusion du soluté d’une phase à l’autre. Les vitesses d’extraction sont d’autant plus grandes que les différences de concentration en soluté des deux phases en contact sont grandes, et que la surface d’échange entre les deux phases est grande. L’agitation du milieu a pour effet d’augmenter la surface de contact entre les phases et de favoriser la diffusion du soluté au sein de chaque phase. La séparation ou décantation comprend la coalescence des fines gouttelettes de la phase dispersée en grosses gouttes, le regroupement de ces gouttes et leur rassemblement en une phase continue distincte de l’autre. Les émulsions stables, c’est à dire qui ne présentent pas de phénomène de coalescence sont à proscrire. La décantation sera d’autant plus rapide que l’on utilisera des liquides ayant des tensions superficielles élevées, ne donnant pas des gouttes trop petites (ordre du mm), dans une phase continue de faible viscosité. Des masses volumiques suffisamment éloignées favorisent l’opération.
2
Coefficient de partage ou de distribution : La distribution, ou le partage d’un soluté entre les deux phases à l’équilibre est donnée par le coefficient de partage (ou de distribution, ou de répartition). Cette grandeur se définit comme le rapport des teneurs respectives en soluté dans l’extrait et le raffinat lorsque l’équilibre est réalisé. Ce coefficient varie avec la nature des constituants en présence, leurs concentrations et la température. Il est peu influencé par la pression. Il est constant dans le cas de mélanges idéaux, constitués de molécules non associées pour lesquels la loi de Raoult s’applique et lorsque les deux liquides (diluant et solvant) sont parfaitement non miscibles. Dans ce cas la variation de y en fonction de x est une droite dont le coefficient directeur est le coefficient de partage.
om
Dans tous les autres cas on le détermine expérimentalement pour chaque équilibre et y = f(x) est représenté par une courbe appelée courbe de partage. Kc = y A / x A
.c
y A et x A sont les titres en soluté dans l’extrait et le raffinat.
Représentation graphique des mélanges ternaires :
un iv
Il y a plusieurs façons de représenter des mélanges à 3 constituants : diagramme triangulaire équilatéral, diagramme triangulaire rectangle, diagramme de distribution, diagramme de sélectivité, diagramme de Janecke. On utilisera le diagramme triangulaire équilatéral (solvant et diluant partiellement miscible).
dz
Le diagramme ternaire : C
% de B dans M
% de A dans M Isotherme de solubilité
Pc : Point critique tel que L, V, E, et R soient
M
E
- Conodale : caractérise l’équilibre entre E et R % de C dans M
- Isotherme de solubilité : A une T° donnée, on peut définir en tout point du diagramme les 2 zones Conodale suivantes :
R L
Chaque sommet représente un composé pur, chaque côté un binaire et chaque point un ternaire dont la composition se lit comme indiqué ci-contre.
A
B V
Zone de non miscibilité (2 phases) Zone de miscibilité (1phase)
3
Chaque sommet A, B, C est représentatif d’un des trois corps purs considérés. Chaque côté représente le mélange binaire des deux corps indiqués aux sommets correspondants. On peut sur chaque côté représenter la fraction (massique ou molaire) de l’un des deux corps. Nous raisonnerons sur les masses, tous les résultats obtenus par la suite seront, bien sûr, applicables au nombre de moles. Par exemple, sur le côté AB, on lira la teneur en B dans le sens A (0 %) vers B (100 %) ; la teneur en A se lira dans le sens opposé.
Sur la figure ci-contre, le point M est représentatif d’un mélange de A (40 %) et B (60 %). Dans le cas d’un mélange ternaire, tel celui représenté par le point M ’, on lit ses teneurs en A, B, C en projetant parallèlement aux côtés
om
BC, AC et AB respectivement. Ainsi M’est un mélange de A (70 %), B (10 %) et C (20 %).
.c
1) Relations barycentriques :
Soient deux points quelconques M 1 et M 2 situés dans le diagramme triangulaire : ils
un iv
représentent deux mélanges M1 et M2 de composition donnée ; si on note X Mi , Y Mi et Z Mi les fractions massiques en A, B et C du mélange Mi et Mi sa masse totale, la position du point M 3 qui représente le mélange de M1 et M2 est donnée par les bilans matière suivants : Masse totale : m 3 = m 1 + m 2
m3 XM 3 = m1 XM 1 + m2 XM 2
Masse de B :
m3 YM 3 = m1 YM 1 + m2 YM 2
Masse de C :
m 3 ZM 3 = m 1 ZM 1 + m 2 ZM 2
dz
Masse de A :
Ces relations traduisent le fait que le point M 3 est le barycentre des points M 1 et M 2 affectés de coefficients égaux aux masses totales des mélanges correspondants. Le point M 3 est donc situé sur la droite M 1 M 2 et sa position est donnée par la relation : 𝑴𝑴𝟑𝟑𝑴𝑴𝟏𝟏 𝐦𝐦𝟐𝟐 = 𝑴𝑴𝟑𝟑𝑴𝑴𝟐𝟐 𝐦𝐦𝟏𝟏 Avec M 3 M i longueur du segment. Si les trois composants d’un mélange sont
miscibles
en
toutes
proportions,
le
système
est
inutilisable en extraction liquide-liquide. Au contraire, les systèmes présentant deux phases liquides dans certaines zones de compositions ont de l’intérêt. Il en résulte sur leur diagramme triangulaire un domaine de
4
démixtion (ou zone de non-miscibilité) limité par une courbe appelée courbe binodale. Tout mélange M dont le point représentatif est à l’intérieur de ce domaine se sépare en deux phases liquides représentées par les points L et K situés sur la courbe binodale et de compositions différentes de celle de M. La phase K est ici plus riche en A que la phase L. La règle de la variance s’écrit dans ce cas, car température et pression sont fixées. Le nombre de constituants indépendants c est égal à 3 et le nombre de phase à 2. La variance v est alors égale à 1. Pour une phase saturée donnée, L par exemple, il existe une seule phase liquide K en équilibre avec elle. La droite LK est appelée droite de conjugaison. C’est une donnée expérimentale. Les deux parties de la courbe binodale représentent l’évolution des compositions des deux phases liquides saturées en équilibre. Divers types de domaines de démixtion peuvent exister selon
om
les propriétés physico-chimiques des trois mélanges binaires. Dans le cas de la figure cicontre, le domaine situé entre le sommet A et la courbe binodale est celui des solutions
.c
homogènes, car seuls les corps purs B et C sont non totalement miscibles.
2) Détermination des conodales :
un iv
C
Une fois l’isotherme de solubilité établie, on balaie la hauteur de la zone de non miscibilité avec des points figuratifs. On réalise les mélanges
dz
M
correspondant que l’on laisse décanter dans des ampoules puis on titre en soluté extrait et raffinat dont les points figuratifs (R&E) doivent être alignés avec le point figuratif du mélange initial M.
A
E
R B
5
** partie pratique ** 1) Matériel utilisé : • • • •
Burette Eprouvette Erlenmeyers Béchers
2) Produits utilisé : • • •
Ethanol Toluène Eau distillé
3) Mode opératoire :
dz
un iv
.c
om
Dans un premier temps on verse dans un bécher un volume bien déterminé du toluène à l’aide d’une éprouvette graduée, après on ajoute le volume correspond dans le tableau d’eau distillé, en suite on verse le mélange dans un erlenmeyer pour faire le dosage avec l’éthanol, l’équilibre atteint quand le mélange devient une seule phase, en fin on lit le volume d’éthanol ajouté. On peut assimiler ce mode opératoire par le schéma suivant
6
4) TABLEAU DE RESULTATS : échantillon
1
2
3
4
5
6
7
8
9
10
11
V eau
0 ,5
1
2
3
4
5
6
7
8
9
9.5
V toluène
9,5
9
8
7
6
5
4
3
2
1
0.5
V éthanol
1.8
8,0
9,3
14,5
15,6
18.5
16.5
15.5
12.5
11.0
9,4
5) Exploitation des résultats : 5-1) Les données du TP :
Masse volumique de
Masse volumique du
l’eau
toluène
l’éthanol
1 g.mL-1
0.87 g.mL-1
0.803 g.mL-1
.c
om
Masse volumique de
un iv
5-1-1) La masse des constituants et la masse totale : Le rapport massique de chaque constituant est calculé par : 𝑗𝑗=3
On a :
Avec
⍴i * Vi =mi
dz
Xi = [(⍴i * Vi) / ∑𝑗𝑗=1 ⍴𝑖𝑖 ∗ 𝑉𝑉𝑉𝑉 ]*100
Masse volumique =
𝐦𝐦𝐦𝐦𝐦𝐦𝐦𝐦𝐦𝐦 𝐝𝐝𝐝𝐝 𝐜𝐜𝐜𝐜𝐜𝐜𝐜𝐜𝐜𝐜𝐜𝐜𝐜𝐜𝐜𝐜𝐜𝐜𝐜𝐜𝐜𝐜 𝐯𝐯𝐯𝐯𝐯𝐯𝐯𝐯𝐯𝐯𝐯𝐯 𝐭𝐭𝐭𝐭𝐭𝐭𝐭𝐭𝐭𝐭𝐭𝐭
Masse du constituant = masse volumique × volume total 5-2) Calcul (exemple type) des différentes masses et le pourcentage massique: m toluène = ρ toluène × V toluène = 0.87 × 9.5 m toluène = 8.27 g m eau = ρ eau × V eau = 1 × 0.5 m eau = 0.5 g 7
m éthanol = ρ éthanol × V éthanol = 0.803 × 1.8 m éthanol = 1.45 g m total = m eau + m toluène + m éthanol = 0.5 + 8.27 + 1.45 m total = 10.22 g X eau = m eau / m total = 0.5 / 10.22 X eau = 0.05 X éthanol = m éthanol / m total = 1.45 / 10.21 X éthanol = 0.15
om
X toluène = m toluène / m total = 8.27 / 10.21 X toluène = 0.80
X
éthanol
1
3
4
5
1 7,83 6,42 15,25 0,06 0,52
2 6,96 7,47 16,43 0,12 0,43
3 6,09 11,64 20,73 0,15 0,29
4 5,22 12,53 21,75 0,18 0,24
0,42
0,45
0,56
0,58
un iv
0,5 8,27 1,45 10,21 0,05 0,80
2
dz
Echantillon m eau (g) m toluène (g) m éthanol (g) m tot (g) X eau X toluène
.c
On refait la même chose pour les autres on trouve :
0,15
Echantillon m eau (g) m toluène (g) m éthanol (g) m tot (g) X eau X toluène
6
7
8
9
10
11
5 4,35 14,86 25,20 0,2 0,18
6 3,48 13,25 22,73 0,27 0,15
7 2,61 12,45 22,05 0,32 0,12
8 1,74 10,03 19,78 0,40 0,1
9 0,87 8,84 18,70 0,48 0,047
9,5 0,44 7,55 17,48 0,54 0,03
X
0,59
0,58
0,56
0,50
0,49
0,43
éthanol
8
6) Représentation graphique : Voir le papier millimétrique.
7) Interprétation du graphe : La solubilité maximum de toluène dans l'eau n'est que de 0,05 g/100g. L'éthanol est totalement miscible avec l'eau et l'éthanol est totalement miscible avec le toluène. Toutefois, l'éthanol est partiellement miscible avec l'eau et le toluène. L'ajout d'éthanol à l'eau et le toluène va produire un schéma monophasé puisque tous les liquides sont miscibles. Dans ce cas, l'éthanol sert de substances polaires intermédiaires, il peut déplacer l'équilibre électronique de l'eau polaire et le toluène non polaire.
om
Sur la base des résultats obtenus, quand il y a un pourcentage plus élevé du toluène par rapport au pourcentage de l’eau, le volume de l’éthanol nécessaire pour titrer le mélange jusqu'à disparition des troubles est plus faible. La nébulosité n'apparaîtra que s’il y a existence
.c
de deux phases. Cela signifie que le pourcentage élevé d'éthanol augmente la miscibilité entre les trois composantes. Une seconde phase est uniquement séparée quand la proportion
un iv
d'éthanol ajoutée dépasse le pourcentage théorique dans lequel trois composants sont partiellement miscibles.
La courbe tracée sur le diagramme de phase triangulaire est généralement connue comme courbe binomiale. La zone délimitée par la courbe binomiale indique une région à deux
dz
phases tandis que la zone à l'extérieur de la courbe est la région monophasée 2.
2
Technique de l’ingénieur (Extraction liquide-liquide, Bases physico-chimiques des procédés) J2761. Gérard COTE.
9
10
om
.c
un iv
dz
Grace à cette manipulation nous avons pu dessiner le diagramme triangulaire équilatéral du ternaire eau-éthanol-toluène. Ce diagramme représente la courbe de miscibilité du ternaire précédant, tel qu’en dessus de cette courbe, on a un mélange homogène (l‘éthanol a solubilisé le toluène et l’eau et on observe une seule phase liquide et en dessous de cette courbe on a un mélange hétérogènes, on observe deux phases liquides. On peut dire, qu’à l’aide de ce TP, nous avons pu lier les phénomènes thermodynamiques avec ceux de transfert de matière à savoir la miscibilité partielle et l’extraction liquideliquide.
om
La technique d’extraction est très importante dans l’industrie et elle joue un rôle primordial dans le domaine de séparation.
dz
un iv
.c
Il faut mentionner qu’avec cette technique, on arrive jamais à extraction complète car on ne dispose pas d’un solvant qui permet la parfaite séparation des composés.
11
Related Documents

Tp Compte Rendu 1
February 2021 0
Compte Rendu Tp 4 Resaux
February 2021 1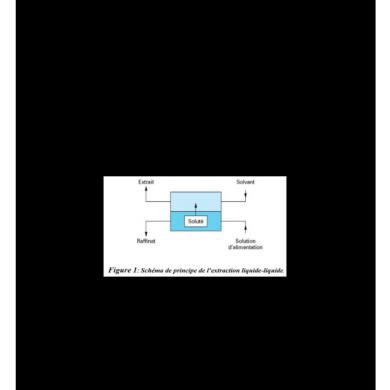
Tp Extraction
March 2021 0
Tp
February 2021 5
Tp Metasploit
January 2021 2More Documents from "hamza syaho"

