Previo Azeotropos
This document was uploaded by user and they confirmed that they have the permission to share it. If you are author or own the copyright of this book, please report to us by using this DMCA report form. Report DMCA
Overview
Download & View Previo Azeotropos as PDF for free.
More details
- Words: 950
- Pages: 4
Loading documents preview...
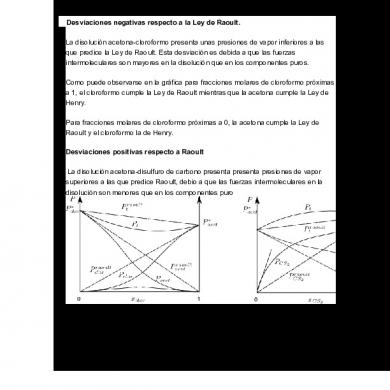
1. Explique porqué algunas soluciones presentan desviaciones positivas y otras presentan desviaciones negativas Desviaciones negativas respecto a la Ley de Raoult. La disolución acetona-cloroformo presenta unas presiones de vapor inferiores a las que predice la Ley de Raoult. Esta desviación es debida a que las fuerzas intermoleculares son mayores en la disolución que en los componentes puros. Como puede observarse en la gráfica para fracciones molares de cloroformo próximas a 1, el cloroformo cumple la Ley de Raoult mientras que la acetona cumple la Ley de Henry. Para fracciones molares de cloroformo próximas a 0, la acetona cumple la Ley de Raoult y el cloroformo la de Henry. Desviaciones positivas respecto a Raoult La disolución acetona-disulfuro de carbono presenta presenta presiones de vapor superiores a las que predice Raoult, debio a que las fuerzas intermoleculares en la disolución son menores que en los componentes puro
2.- Explique por que es la actividad y el coeficiente de actividad y como se relacionan las propiedades de exceso y la utilidad que tienen en la descripción del equilibrio liquido vapor.
la actividad es una medida de una "concentración efectiva" de una especie. Surge debido a que las moléculas en un gas o solución no ideal interactúan unas con otras. La actividad no tiene dimensiones. Se hace adimensional utilizando la fracción molar para su cálculo. La actividad depende de la temperatura, presión y composición. Para los gases, la presión efectiva parcial se suele referir como fugacidad. Los efectos de la actividad son el resultado de las interacciones entre los iones, tanto electrostáticas como covalentes. La actividad de un ion está influenciada por su ambiente. La actividad de un ion en una jaula de moléculas de agua es diferente de estar en el medio de una nube de contraiones. Este tipo de actividad es relevante en la química para la constante de equilibrio y constante de reacción. Por ejemplo, pueden existir grandes desviaciones entre la concentración de iones hidrógeno calculada de un ácido fuerte en solución, y la actividad de hidrógeno derivada de un pHmetro, o indicador de pH. En mezclas ideales se puede escribir la dependencia del potencial químico de una especie y en la composición (expresada como fracción molar X de i) como:
Se puede usar esta fórmula para definir una actividad a, insistiendo en que el mismo formalismo se mantiene en el caso no ideal.
Evidentemente, en el caso ideal: a=X. Para un caso no ideal, la actividad es la concentración efectiva. Se puede definir un coeficiente de actividad γ: ai = γi xi Sin embargo, hay varios esquemas alternativos para definir la actividad. Para soluciones diluidas, generalmente el solvente sigue la ley de Raoult, pero el soluto sigue la ley de Henry. Frecuentemente es conveniente el uso de estas leyes como base para una definición: Raoult: Psolvente = P*solvx2 Henry: Psoluto = Ksolux1
Donde P*solv es la presión de vapor del solvente puro y Ksolu es la constante de Henry. Definiendo las actividades: a2 ≡ Psolvente/ P*solvente a1 ≡ Psoluto/ Ksoluto Como Ksoluto ≠ P*soluto, esto implica la elección de un punto de referencia diferente. Esto representa a la extrapolación de la línea de Henry hasta x1 =1 y éste es un estado virtual: un estado del sistema que nunca puede ser alcanzado. Sin embargo, la definición conduce a un sistema consistente de valores mientras no se haga x1 demasiado grande. Lo mismo se puede sostener si se usan molaridades o molalidades, como con las fracciones molares. Se puede usar con seguridad tales definiciones, pero el significado de o diferirá, al escoger un punto de referencia diferente. Esto implica que el valor de μo será diferente bajo estos sistemas de referencia diferentes. Frecuentemente se prefieren molalidades en este tipo de cálculos, porque los volúmenes de mezclas no ideales no son estrictamente aditivas. Las molalidades no dependen del volumen, las molaridades sí. La actividad es un proceso que nos sirve para modelar un proceso real a partir de uno no ideal, y es para líquidos, es decir, corrige la no idealidad de los líquidos, a diferencia de la fugacidad que lo hace para gases El coeficiente de actividad es un número que expresa el factor de actividad química de una sustancia en su concentración molar. Se designa normalmente con la letra griega
(gamma).
La concentración medida de una sustancia no puede ser un indicador preciso de su eficacia química como se representa por la ecuación de una reacción particular; en dichos casos, la actividad es calculada al multiplicar la concentración por el coeficiente de actividad.
En los solutos, el coeficiente de actividad es una medida de cuanto la solución difiere de unadisolución ideal.
Diagrama de flujo
Armar Armar el el dispositivo dispositivo de destilación de destilación
Colocar piedras de Colocar piedras de ebullición ebullición
Añadir Añadir 10 10 mL mL de de agua agua al al matraz, matraz, calentar el agua a calentar el agua a punto punto de de ebullicón ebullicón y y permanecer permanecer constante constante
Añada 3 3 mL mL de de Añada propanol propanol
Calentar solución, Calentar la la solución, tomar de tomar indice indice de refracción refracción
añadir añadir 3 3 mL mL de de nnpropanol propanol
Medir indice de de Medir indice refracción refracción
Hacer Hacer adiciones adiciones sucesivas sucesivas de de propanol 4y y3 mL propanol de de 4 3 mL en en cada cada adición adición medir e medir temperatura temperatura e indice indice de de refracción refracción
Repetir Repetir todo todo desde desde el el punto punto 1, 1, solo solo iniciar iniciar con con 7 7 mL mL de de propanol propanol y y y añadir añadir 0.2 0.2 0.3 0.3 0.5 0.5 y 1 agua 1 mL mL de de agua
2.- Explique por que es la actividad y el coeficiente de actividad y como se relacionan las propiedades de exceso y la utilidad que tienen en la descripción del equilibrio liquido vapor.
la actividad es una medida de una "concentración efectiva" de una especie. Surge debido a que las moléculas en un gas o solución no ideal interactúan unas con otras. La actividad no tiene dimensiones. Se hace adimensional utilizando la fracción molar para su cálculo. La actividad depende de la temperatura, presión y composición. Para los gases, la presión efectiva parcial se suele referir como fugacidad. Los efectos de la actividad son el resultado de las interacciones entre los iones, tanto electrostáticas como covalentes. La actividad de un ion está influenciada por su ambiente. La actividad de un ion en una jaula de moléculas de agua es diferente de estar en el medio de una nube de contraiones. Este tipo de actividad es relevante en la química para la constante de equilibrio y constante de reacción. Por ejemplo, pueden existir grandes desviaciones entre la concentración de iones hidrógeno calculada de un ácido fuerte en solución, y la actividad de hidrógeno derivada de un pHmetro, o indicador de pH. En mezclas ideales se puede escribir la dependencia del potencial químico de una especie y en la composición (expresada como fracción molar X de i) como:
Se puede usar esta fórmula para definir una actividad a, insistiendo en que el mismo formalismo se mantiene en el caso no ideal.
Evidentemente, en el caso ideal: a=X. Para un caso no ideal, la actividad es la concentración efectiva. Se puede definir un coeficiente de actividad γ: ai = γi xi Sin embargo, hay varios esquemas alternativos para definir la actividad. Para soluciones diluidas, generalmente el solvente sigue la ley de Raoult, pero el soluto sigue la ley de Henry. Frecuentemente es conveniente el uso de estas leyes como base para una definición: Raoult: Psolvente = P*solvx2 Henry: Psoluto = Ksolux1
Donde P*solv es la presión de vapor del solvente puro y Ksolu es la constante de Henry. Definiendo las actividades: a2 ≡ Psolvente/ P*solvente a1 ≡ Psoluto/ Ksoluto Como Ksoluto ≠ P*soluto, esto implica la elección de un punto de referencia diferente. Esto representa a la extrapolación de la línea de Henry hasta x1 =1 y éste es un estado virtual: un estado del sistema que nunca puede ser alcanzado. Sin embargo, la definición conduce a un sistema consistente de valores mientras no se haga x1 demasiado grande. Lo mismo se puede sostener si se usan molaridades o molalidades, como con las fracciones molares. Se puede usar con seguridad tales definiciones, pero el significado de o diferirá, al escoger un punto de referencia diferente. Esto implica que el valor de μo será diferente bajo estos sistemas de referencia diferentes. Frecuentemente se prefieren molalidades en este tipo de cálculos, porque los volúmenes de mezclas no ideales no son estrictamente aditivas. Las molalidades no dependen del volumen, las molaridades sí. La actividad es un proceso que nos sirve para modelar un proceso real a partir de uno no ideal, y es para líquidos, es decir, corrige la no idealidad de los líquidos, a diferencia de la fugacidad que lo hace para gases El coeficiente de actividad es un número que expresa el factor de actividad química de una sustancia en su concentración molar. Se designa normalmente con la letra griega
(gamma).
La concentración medida de una sustancia no puede ser un indicador preciso de su eficacia química como se representa por la ecuación de una reacción particular; en dichos casos, la actividad es calculada al multiplicar la concentración por el coeficiente de actividad.
En los solutos, el coeficiente de actividad es una medida de cuanto la solución difiere de unadisolución ideal.
Diagrama de flujo
Armar Armar el el dispositivo dispositivo de destilación de destilación
Colocar piedras de Colocar piedras de ebullición ebullición
Añadir Añadir 10 10 mL mL de de agua agua al al matraz, matraz, calentar el agua a calentar el agua a punto punto de de ebullicón ebullicón y y permanecer permanecer constante constante
Añada 3 3 mL mL de de Añada propanol propanol
Calentar solución, Calentar la la solución, tomar de tomar indice indice de refracción refracción
añadir añadir 3 3 mL mL de de nnpropanol propanol
Medir indice de de Medir indice refracción refracción
Hacer Hacer adiciones adiciones sucesivas sucesivas de de propanol 4y y3 mL propanol de de 4 3 mL en en cada cada adición adición medir e medir temperatura temperatura e indice indice de de refracción refracción
Repetir Repetir todo todo desde desde el el punto punto 1, 1, solo solo iniciar iniciar con con 7 7 mL mL de de propanol propanol y y y añadir añadir 0.2 0.2 0.3 0.3 0.5 0.5 y 1 agua 1 mL mL de de agua
Related Documents
Previo Azeotropos
January 2021 1
Reporte Azeotropos
January 2021 1
Informe Previo 1 Ee422n
January 2021 3
Previo 06 - Ce-ii
January 2021 1
Previo Susceptibilidad Magnetica
February 2021 1
Informe Previo 6
February 2021 2More Documents from "Gin Dlc"
