Tugas Rutin Kimia
This document was uploaded by user and they confirmed that they have the permission to share it. If you are author or own the copyright of this book, please report to us by using this DMCA report form. Report DMCA
Overview
Download & View Tugas Rutin Kimia as PDF for free.
More details
- Words: 14,220
- Pages: 81
Loading documents preview...
SOAL BAB I Halaman 14 1.Lengkapi jumlah proton ,neutron dan nukleteon pada nuklida berikut No 1 2 3 4
Nuklida
Jumlah proton (z)
Hg201 201 79Au 202 80Hg 202* 80Hg
80 79 80 80
80
Jumlah Neutron (N) 121 120 120 120
JumlahNukleon (A) 201 201 202 202
2. Berdasarkan kesamaan jumlah proton ,neutron,dan nucleon,nuklida diatas dapat dikelompokkan menjadi : 1.isotop: 80Hg201dengan80Hg202 2.isobar: 80Hg201dengan79Au201 3. isoton:79Au201dengan 80Hg202 4. isomerinti :80Hg202dengan 80Hg202* 3.Lengkapi sifat dan contoh klasifikasi nuklida berikut : No 1 2 3
4 5
JenisNuklida Nuklida Stabil Radionuklida alam primer
Sifat -N/Z>1 -radioaktif -waktu paruhnya panjang -terbentuk secara alami Radionuklida alam -waktu paruhnya pendek sekunder -tidak dapat ditemukan dialam ,tetapi dapat dibentuk secara kontinu Radio nuklida alam -dipengaruhi oleh interaksi sinar terinduksi kosmik diatmosfer Radionuklidabuatan -terbentuk tidak secara alamiah tetapi hasil sintesis -dapat memancarkan jenis radiasi alpa,beta,gamma,dan neutron.
4. Ada empat factor yang menentukan kestabilan inti yaitu: 1.perbandingan neutron terhadap proton 2.mempunyainomor atom rendah ,nilai n/p mendekati 1
Contoh 4 2He 238 92u Th234
90
C14 ,7N14
6
Bidang kedokteran :24Na untuk mendeteksi adanya gangguan peredaran darah Bidang pertanian37P dan14C Untuk mengetahui tempat pemupukan yang tepat
3. meningkatnya hormone atom,perbandingan neutron terhadap proton dan inti stabil menjadi lebih besardari 1 4. penyimpanan pada nomor-nomor atom yang lebihtinggi 5.Lengkapi table berikut untuk 3 macam inti yang tidak stabil ,cara mencapai stabil dan reaksi yang terjadi
No 1
Intitakstabil Diatas pita kestabilan (Z<83)
2
Z>83
3
Dibawah pita kestabilan
Cara mencapaistabil Nuklida ini mengubah neutron menjadi proton danpartikel beta Melepas sejumlah partikel alfa (inti atom He) Memancarkan positron ataupenangkapan electron
Reaksi 137 53I
P1
1
P136+0n1
53
n1+1e0
0
Be7+-1e0
4
Li7
3
6. Lengkapi tabel berikut untuk Jenis Peluruhan Zat Radioakif
No Jenis Peluruhan 1 Peluruhan alfa (α) 2
Peluruhan Beta - Pemancaran negatron ( ) - Pemancaran posiotron (
Persamaan Umum → z-2
+2
→ z+1 Z + 1 → z-1 Y + →-
Contoh 210 →84Pb206 + 2He4 84Po
+
K40→20Ca40 + -1β0 40 40 0 20Sc →20Ca + +1β 44 0 44 22Ti + -1e → 21Sc 19
→ Z-1
)
3 4 5 6
7.
- Penangkapan erlectron (Electron capture, EC). Peluruhan gamma (Transisi isomerik) Pembelahan spontan Pemancaran Neutron Pemancaran neutron terlambat
→ 2AX + -
C060m→27Co60 + y’
22
Cf254→42Mo108+56Ba142+40n1 87 87 1 36Kr →36Kr + 0n 87 87 0 87 35Br →36Kr + -1β →36Kr + 1 0n 98
Transmutasi Inti adalah penembakan nuklida suatu atom dengan proyektil atomik sehingga terbentuk nuklida baru yang stabil. Reaksi umum M (a,b) M’ M : Inti yang ditembak. a : proyektil atom yang menembak.
b. Partikel yang dibebaskan pada reaksi nuklir. M’ : inti hasil penembakan Contoh reaksi transmutasi inti :7N14 (α, p) 8O17 Ada dua macam proyektil yaitu : 1) Partikel bermuatan contoh 1H1, 1H2, 2He4, atau 6C12. 2) Partikel bermuatan contoh neutron 8.
Selesai massa suatu inti terhadap massa nukleon pembentuknya disebut Defek massa Selisih massa ini bila dikonversikan ke energi sesuai dengan persamaan Einstein adalah merupakan harga energi pengikat inti.
9.
Jika harga energi pengikat inti ini dibagi dengan jumlah proton + neutron (nukleon) disebut Energi pengikat inti per nukleon.
10. Hitung energi pengikat inti dan energi pengikat inti pernukleon (MeV) dari 2He4 dan 26Fe56 jika massa satu proton = 1,0078 sma, massa satu neutron = 1,0087 sma, massa atom He = 4,0026 sma dan massa Fe = 55,9349 sma. Untuk menyelesaikan soal di atas dapat juga digunakan rumus : Energi ikat inti = (Z x Mp) + ((A-Z) x Mn) – MA x 931 MeV Dimana : Z = nomor atom (jumlah proton), Mp = massa proton, A = nomor massa (jumlah proton + jumlah neutron), Mn = massa neutron, MA = Massa Atom Jadi : a) 2He4 Energi pengikat inti 2He4 = (Z x Mp) + ((A-Z) x Mn) – MA x 931 MeV = ((2 x 1,0078) + ((4 – 2 ) x 1,00866) – 4,0026) x 931 MeV)) = (2,0156) = (2 x 1,00866) – 4,0026) x 931 MeV = (2,0156 + 2,01732 – 4,0026) x 931 MeV = 0,03128 X 931 MeV = 29,12168 MeV 56 b) 26Fe Energi pengikat inti 26Fe56 = (Z x Mp) + ((A-Z) x Mn) – MA x 931 MeV = (26,1893 + 30,2598 – 55,9349) x 931 MeV = 0,5142 x 931 MeV = 478,72 MeV 11. Peluruhan radioaktif mengikuti laju reaksi orde ke satu. Laju peluruh berbanding lurus dengan junlah radionuklida, yang dinyatakan dengan : -dN/dt = N, dimana N = ........ t =...... perbandingan diatas dapat diubah menjadi suatu persamaan dengan memasukkan tetapan perbandingan
, menjadi : -dN/dt = N. Penyelesaian persamaan peluruhan
adalah? Hubungan anatara tetapan peluruhan dan waktu paruh (t1/2) adalah : (t1/2) ?
Penyelesaian : N = Jumlah radioanuklida t = Waktu Persamaan peluruhan dari -dN/dt = N : -dN/dt = N
laju perubahan = keaktifan ( A = -dN/dt atau A = N )
-dN/N = - t
/N = -
In N
No = - t
In N/No = - t atau In A/Ao = - t N/No =
12.
atau N = No
Ditemukan tulang suatu binatang purba yang mempunyai keaktifan C 14 3,75 dpm/g. Perkirakan berapa yahun yang lalu binatang itu hidup (t1/2 C14 = 5668 tahun). Keaktifan C14 mula-mula = 15,3 dpm/g. Penyelesaian : Dik : t1/2 C14 = 5668 tahun N
= 2,75 dpm/g
NO
= 15,3 dpm/g
Dit : t = ....? Jawab : t1/2 = 0,693/ = 0,693/t1/2 = 0,693/56668
In(N/No) = - t 2,303 log N/No = - t 2,303 log 2,75/15,3 = -(0,693/56668) . t 2,303 x (-0,745) = -1,22 x 10-4tahun . t t = 14063 tahun
13.
Suatu isotop radioaktif mempunyai waktu paruh 5 hari. Berapa persen radio isotop tersebut yang sisa bila tersimpan 25 hari. Penyelesaiian : Sisa = (1/2)n x 100% n = Waktu paruh 30 hari/5hari = 6 Sisa = (1/2)6 x 100% = (1/64) x 100% = 1,56%
14.
Lengkapi perbedaan antara reaksi fisi dan reaksi fusi pada tabel berikut
Jenis Reaksi Fisi
Pengertian Pembelahan inti berat menjadi dua inti dengan nomor massa yang lebih kecil
Contoh -
U235 + 0n1
92
Mo103 + 50Sn131 + 2 1 0n -
Energi yang dibebaskan
235
U
92
500 ton
1
+ 0n
Ba141 + 50Kr92+ 3 1 0n Fusi
Penggabugan dua - 4 1H1 2He4 + 2 inti ringan menjadi yang lebih berat, inti e0 + energi menjadi lebih stabil. 1
20.000 ton
-
H1 + 1H3
1
He4
2
+ 1e0 + energi
15. Lengkapi konversi satuan berikut 10 Ci
= 37.10 10 desintegrasi/s = 37.10 10 Bq
1000 rad = 1 Gy 16. Mana yang lebih merusak radiasi 100 rad sinar alfa atau 100 rad sinar beta. Berikan penjelasannya Jawab : 100 rad sinar alfa lebih merusak daripada 100 rad sinar beta. Karena partikel sinar alfa memiliki beban yang lebih besar daripada sinar beta. Oleh karena itu rad biasanya dikalikan drngan faktor yang mengukur kerusakan biologi relatif yang disebabkan oleh radiasi. Faktor ini disebut REB ( Relative Biologycal Effetiveness of Radiation). Hasil kali rad dan REB menghasilkan dosis yang disebut rem(Rontgen Equivalen for Man). 17. Efek radiasi tergantung pada 1. 2. 3. 4.
Energi radiation Kemampuan daya tembus radiasi Kemampuan pengionan dari radiasi Sifat kimia dari sumber radiasi
18. Lengkapi tabel berikut untuk penggunaan radioisotop:
No
Bidang
1
Kimia
Radioisotop yang digunakan Teknik peruntun
2
Kedokteran
24
24
131
Na Na Cl I
Fosfor 59Fe
3
Pertanian
Radiasi gamma fosfor
Digunakan sebagai Untuk mempelajari mekanisme berbagai reaksi kimia. Untuk mengikuti peredaran darah dalam tubuh. Untuk mengetahui penyumbatan dalam saluran darah. Untuk mempelajari kelainan pada kelenjar tiroid. Untuk menentukan tempat tumor otak. Untuk mengukur laju pembentukan sel darah merah dalam tubuh dan menentukan apakah besi dalam makanan dapat digunakan dengan baik dalam tubuh. Untuk memperoleh bibit unggul. Untuk pemakaian pupuk oleh tanaman.
4
Industri
Penggunaan radioisotop Penyiraman radiasi
Untuk mendeteksi kebocoran pipa yang ditanam dalam tanah atau beton. Untuk menentukan keausan dan keroposan yang terjadi pada bagian pengelasan logam.
Halaman 2 Tugas Rutin 01 : Radio Kimia Soal Pilihan Berganda 1. Nuklida
U238 memiliki partikel dibawah ini kecuali...
92
a. 92 proton
b. 92 elektron c. 92 neutron d. 146 neutron e. 238 nukleon
Jawab: C. 92 Neutron 2. Untuk reaksi : 48Cd104 47Ag104+ X, X adalah... a. proton b. elektron c. positron d. neutron e. gamma Jawab: C. Positron 3. Kedua nulida 14Si30, 15P31 disebut... ba. isotop b. isobar c. isoton d. isomer e. isoelektron Jawab: C. Isoton 4. Kedua isotop 54Xe130 , 56Ba130 disebut... a. isotop b. isobar c. isoton d. isomer e. isoelektron Jawab: B. Isobar 5. Unsur dibawah ini yang intinya paling stabil adalah... a. 6C12 b. 8O16 c. 14Si28 d. 26Fe56 e. 29U238 12 Jawab: A. 6C 6. Inti dengan susunan dibawah ini yang lebih stabil adalah... a. 90 proton dan 147 neutron b. 90 proton dan 144 neutron c. 91 proton dan 147 neutron d. 91 proton dan 144 neutron Jawab: A. 90 proton dan 147 neutron 7. Untuk proses 13Al27 (α,x) 15P30 , x adalah... a. sinar alfa b. sinar gamma c. neutron Jawab: C. Neutron 8. Untuk proses 7N15 (p,x) 6C12, x adalah : a. Positron b. Neutron c. Sinar beta d. Sinar alfa e. Deuteron
d. proton
Jawab: N15 +
7
+ 6C12 karena x adalah sinar alfa yang bermuatan +
9. Untuk proses 13Al27(x,α) 12Mg25 , X adalah : a. Neutron
e. positron
b. c. d. e.
Deuteron Positron Proton Electron
Jawab: Al27 +
+ 12Mg25 , karena x merupakan deutron dikarenakan muatannya
13
10. Suatu nuklida radioaktif mempunyai waktu paruh 50 menit. Sebanyak 640 atom cuplikan radioaktif tersebut meluruh selama 100 menit. Berapa cuplikan yang masih tertinggal? a. 320 atom b. 160 atom c. 120 atom d. 60 atom e. 30 atom Jawab: Dik : No= 640 atom n = t/t1/2 = 100/50= 2 Dit : Nt…? Nt
= No (1/2) n
= 640 (1/2)2 = 160 atom Jadi cuplikan yang masih tertinggal sebanyak 160 atom. 11. Intensitas radiasi yang dipancarkan oleh unsure radioaktif berubah menjadi seperdelapan intensitas awal setelah 48 hari. Waktu paruh unsure radioaktif adalah a. 6 hari b. 8 hari c. 12 hari d. 24 hari e. 16 hari Jawab: Dik : Nt=1/8 No t= 48 hari Dit : t1/2
=…?
Nt/No
= (1/2)t/t1/2
(1/8) No/No
= (1/2)
(1/2)3
= (1/2)48/T1/2
3
= 48/ t1/2
t½
= 16
jadi waktu paruh unsure radioaktif adalah 16 hari. 12. Reaksi manakah yang merupakan reaksi fisi 252 106 142 1 a. 98 Cf 42 Mo 56 Ba 4 0 n 234 4 b. 238 92 U 94Th 2 He 239 239 0 c. 93 Np 94 Pu 1 e d. 147 N 24He178 O 11H 87 86 1 e. 36 Kr 36 Kr 0 n Jawab: a.
252 98
142 1 Cf 106 42 Mo 56 Ba 4 0 n
13. Nuklida yang dipakai sebagai perunut untuk mempelajari kelenjar tiroid adalah : a. C14 b. Fe59 c. Sr90 d. I131 e. U235 Jawab: d. I131. Karena I131 adalah isotop yang selalu memancarkan sinar radiasi yang dapat merunut kelenjar tiroid. 14. Salah satu unsur transuranium adalah : a. Al b. As c. Ar d. Ac e. Am Jawab: e. Am. Amerisium adalah unsur kimia sintetik dalam sistem periodik unsur yang memiliki lambang Am dan nomor atom 95 dan merupakan salah satu unsur dari transurium.
15. Waktu paruh C14 adalah 5730 tahun dan dalam materi hidup laju peluruhannya 15 disintegrasi permenit pergram. Benda kayu zaman purba mempunyai laju peluruhan 1,875 disintegrasi permenit pergram. Umur benda purba tersebut adalah : Jawab: c. 17.160 tahun Dik: No=15 Nt=1,875
T1
2=
5730
Dit: t=? Nt 1 No 2
t
5730
1,875 1 15 2 1 1 8 2 3
t
1 1 2 2
t
5730
t
5730
5730
t
5730
3
t 17.160 tahun
Essay 1. Hitunglah energi ikat pernukleon untuk 1H2 dan 1H3 bila diketahui massa atomnya masingmasing 2,012421 sma dan 3,01605 sma.
Penyelesaian : Dik: Untuk 1H2 Z = 1 , A =2 MA= 2,01421 Untuk 1H3 Z =1,A=3 MA= 3,01605 MP =1,00728 Mn=1,00866
Untuk 1H2 Energi pengikat inti = [(Z X MP) + ((A-Z) X Mn) – MA] X 931 MeV = [(1 X 1,00728) + ((2-1) X 1,00866) – 2,01421] X 931 MeV = [1,00728 + 1,00866 – 2,01421] X 931 MeV = 0,00173 X 931 MeV = 1,61063 MeV
Energi pengikat pernuklean = =1,61063 MeV : 2 = 0,805315 MeV Untuk 1H3 Energi pengikat inti = [(Z X MP) + ((A-Z) X Mn) – MA] X 931 MeV = [(1 X 1,00728) + ((3-1) X 1,00866) – 3,01605] X 931 MeV = [1,00728 +(2 X 1,00866) – 2,01421] X 931 MeV = 0,00855 X 931 MeV = 7,96005 MeV Energi pengikat pernukleon = energi pengikat inti : jumlah nukleon =7,96005 MeV : 3 = 2,65335 MeV 2. Defek massa untuk inti 3Li6 adalah -0,03434 g/mol . Hitunglah massa atom 3Li6 Penyelesaian : Δm -0,03434 - 0,03434 MA MA
= [(Z X MP) + ((A-Z) X Mn) – MA ] = [(3 X 1,00728) + ((6-3) X 1,00866) – MA] = (3,02184 + 1,00866 – MA) = 6,04782 + 0,03434 = 6,08216 sma
3. Sebuah batuan mengandung 0,346 mg pb-206 untuk setiap mg U-238. Waktu paruh uranium menjadi timbale adalah 4,5x109 tahun. Berapa usia batuan tersebut Penyelesaian : Dik Hubungan peluruhan dengan peruh waktu adalah jika t=t1/2 maka; N= ½ No
In ½ No/No = λt ½ λt ½ = In 2 λt ½ = 0,693 t ½ = 0.963/λ dimana t1/2 = 4.5x 109 λ = 0.963/4.5x109 λ= 0.00214 maka; In (N/No) = -λt 2,303 log N/No = -λt 2,303 log 0,346 = -0.00214 t -1,06150/-0.00214 = t t = 496 tahun 4. Suatu cuplikan radio aktif sebanyak 1,0 gram. Cuplikan merupakan pemancar sinar alfa dan diukur keaktifannnya pada keadaan awal dan setelah 7 hari. Hasil pembacaan yang kedua adalah 27,9 % dari keadaan awal. Hitung waktu paruhnya dalam hari. Penyelesaian : Dik : No = 100% Nt = 27,9% t = 7 hari mo = 1 gram Dit : T1/2 = ....? Jwb: Nt/No = e^-∧t 2,303 log Nt/No = -∧t 2,303 log 0,279 = -∧x7 2,303 x (-0,554) = -7∧ ∧ = 0,1824 T1/2 = 0,693/∧ = 0,93/0,1284 = 5,4 hari 5. Tuliskan persamaan reaksi peluruhan di bawah ini : a. Peluruhan alfa dari 95Am241 b. Peluruhan beta dari 13Al28 c. Peluruhan positron dari 6C11
d. Penangkapan elektron dari 16S31 Penyelesaian : a. 95 Am 241 93 Am 237 24 28 28 b. :13 Al 14Y aˆ 1 :13 Al 28 12Y 28 aˆ 1 c. 6 C 11 5 B11 e e d. 2S 2e 2 S
BAB 2 : STRUKTUR ATOM Soal-soal latihan. 1. Apakah sumbangan tiap orang ini terhadap stuktur atom! a. Thomson b. Rutherford c. Bohr d. de Broglie 2. Bagaimanaperbedaan model atom Rutherford denganNiels Bohr? 3. Hitunglahpanjanggelombangseberkas proton yang kecepatannya1,3 × 107m s-1, massa proton adalah 1,67 × 10-24 g! 4. Mengapajumlah proton danjumlah electron harussamadalamsuatu atom ?
5. Sebutkanjumlah proton, elektrondan neutron dari
,
!
6. Sebutkanbilangankuantum orbital 2p! 7. Sebutkanberapa set kemungkinankeempatbilangankuantumuntuk a. n = 5; l = 0 b. n = 4; l = 1 8. tentukanahargabilangankuantumelektronterakhiruntuk11Na, 16S, dan28Ni! 9. Tentukankonfigurasi electron dari20Ca , 35Br, 47Ag, 58Ce, 86Rn, dan91Pa! 10. Barapakahjumlahelektron yang dapatdipunyai atom denganbilangankuantum a. N = 2; l =1 b. n = 3; l= 0 c. n = 3; l = 2; m1= -1 11. Tentukansusunanelektronpadakeadaandasardari atom berikut; 8O,11Na, 12Mg, 20Ca, 24Cr 12. Berapakahjumlahelektrontidakberpasanganpada atom dalamkeadaandasarberikut: a. 14Si b. 29Cu
Penyelesaian: 1. Sumbanganterhadapstruktur atom dari : a. Thomson : memeperkenalkanrumusanatentang atom yang menyatakanbahwa atom adalahmerupakansuatu
bola
padatbermuatanpositifdantersebarelektron-
elektronbermuaannegatifsecaraacak. b. Rutherford : menyatakanstruktur atom bersifatelektronetral, yang berarti memilikijumlahmuatanpositifyanagsamadenganjumlahmuatannegatif. c. Bohr : atom Bohr miripdengan atom hidrogen , yang terdidiriatasintidansatu electron.
Model
atom
Bohr
mampumenjelaskangaris
spectrum
emisidanabsorpsidari atom hidrogendenganmuatanenergitertentu (n = 1, 2, 3, …,∞). d. De Broglie
:
mengemukakan
model
atom
mekanikagelombang.
Ditemukanbahwaelektronmenunjukkansifatdifraksisepertihalnyasinar makalintasan
electron
yang
dikemukakan
Bohr
x,
tidakdibenarkan.
Gelombangtidakbergerakmelaluisuatugaris, melaikanmenyebarpadadaerahtertentu. 2. Perbedaan model atom Rutherford dengan model atom Niels Bohr : - Rutherford menyatakanbahwa merupakansuatumassadenganintibermuatanpositif muatannegatif, -
sedangkan Niels Bohr
jadi
electron
yang
dikelilingiolehmuatan-
bergerakbebasmengelilingi
menyatakanbahwainti
atom
atom
yang
proton
tersebut,
berupa
proton
dikelilingiolehelektron-elektronyanagbergerakdalamlintasan-lintasantertentu.
Sehinggaapabilaelektronberpindahdari orbit awalnyake orbit lainnyadalam atom tersebutakantimbulsuatuloncatanenergi.
3. Diketahui : v = 1,3 × 107m s-1 = 1,3 × 109 cm s-1 m = 1,67 × 10-24 g h = 6,6626 × 10-27 erg. detik Ditanya : panjanggelombang( λ)
Penyelesaian : λ =
=
= 3,069 x 10-10cm
=
4. Jumlah
proton
danelektronharussamakarenaakanmenentukankestabilaninti
tersebut,
kalaujumlah
atom proton
lebihbanyakdibandingjumlahelektronmakaakanmembentuk
ion
poitifdanbegitusebaliknyaapabilajumlahelektronlebihbanyakakanmembentuk
ion
negatif.
Jumlah
proton
dan
neutron
maupuntingkatenergidariinti-inti
stabiltidakakanmengalamiperubahanselamatidakadagangguandariluar. 5. Proton = 23 Elektron= 23 Neutron = massa atom – nomor atom = 23-11 = 12
Proton = 39 Elektron = 39 Neutron = massa atom – nomor atom = 39 – 19 = 20
yang
6. Bilangankuantum orbital 2p: Bilangankuantumutama (n) : 2 Bilangankuantumazimut (l) : 1 Bilangankuantummagnetik (m) : -1 Bilangankuantum spin (s) : + 7. Set kemungkinankeempatbilangankuantum a. n= 5 , l= 0 b. n= 4, l= 1 maka 5s maka 4p 8. Hargabilangankuantumelektronterakhiruntuk : a. 11Na = 1s2 2s22p63s1 1 3s 0
↑ n=
3 , l = 0, m = 0, s = +
b. 16S = 1s2 2s2 2p6 3s2 3p4 4 3p ↑↓ ↑ n= c.
↑
-1
0
+1
3, l=1, m= -1, s = -
Ni = 1s2 2s22p63s23p6 4s23d8 8 3d 28
↑↓ ↑↓ ↑↓ ↑ n =
↑
-2
-1
0
+1 +2
3, l = 2, m= 0, s = +
9. Konfigurasielektrondari : 2 2 6 2 6 2 20Ca = 1s 2s 2p 3s 3p 4s 2 2 6 2 6 2 10 5 35Br = 1s 2s 2p 3s 3p 4s 3d 4p 2 2 6 2 6 2 10 6 2 9 47Ag = 1s 2s 2p 3s 3p 4s 3d 4p 5s 4d 2 2 6 2 6 2 10 6 2 10 6 2 2 58Ce = 1s 2s 2p 3s 3p 4s 3d 4p 5s 4d 5p 6s 4f 2 2 6 2 6 2 10 6 2 10 6 2 14 10 6 86Rn = 1s 2s 2p 3s 3p 4s 3d 4p 5s 4d 5p 6s 4f 5d 6p 2 2 6 2 6 2 10 6 2 10 6 2 14 10 6 2 3 91Pa = 1s 2s 2p 3s 3p 4s 3d 4p 5s 4d 5p 6s 4f 5d 6p 7s 5f 10. Jumlaahelektronpada: a. n=2, l=1 → berartielektronterletakpada sehinggajumlahelektronsebanyak 6 buah. b. n=3, l=0 →berartielektronterletakpada
orbital orbital
sehinggajumlahaelektronsebanyak 2 buah. c. n= 3, l=2, m=-1 → berartielektronterletakpada
orbital
2p 3s 3d
denganbilangankuntummagnetik -1. Ada duakemungkinanjumlahelektronyaitu 2 dan 7. 11. Susunanelektronpadakeadaandasardari atom unsurberikut :
a. 8O = 1s2 2s22p4 b. 11 Na = 1s2 2s22p63s1 c. 12Mg = 1s2 2s22p63s2 d. 20Ca = 1s2 2s22p63s23p6 4s2 e. 24Cr = 1s2 2s22p63s23p6 4s23d4 12. Jumlahelektrontidakberpasanganpada atom dalamkeadaandasarberikut: a. 14Si = 1s2 2s22p63s23p2 Orbital 3p ada 3 buah orbital (kotak). Jumlahelektronpada orbital p seharusya 6. Tetapipada3p2 hanyaterisi 2 orbital. Sehinggajumlahelektrontidakberpasangan da 2 b.
buahelektron. 2 2 6 2 6 2 9 29Cu=1s 2s 2p 3s 3p 4s 3d Orboitalpada 3d ada 5 buah orbital ( kotak). Jumlahmaksimumada 10 tetapipada3d9
hanyaterisidengan
9
elektrondanterdapat
1
buahelektrontidakberpasangan.
Tugas Rutin 02: Kesetimbangan Kimia Soal: 1. Write the equilibrium expression (K) for each of the following gas- phase reactions. a. N2(g) + O2(g) ↔ 2NO(g) b. N2O2(g)↔ 2NO2(g) c. SiH4(g)+ 2Cl2(g)↔ SiCl4(g) + 2H2(g) d. 2PBr3(g) + 3Cl2(g) ↔ 2PCl3(g) + 3Br2(g) 2. Write the equilibrium expression (Kp) for each reaction in exercise 1. 3. For the reaction H2(g) + Br(g) ↔ 2HBr(g) 4 Kp = 3,5 x 10 at 1495 K. what is the value of Kpfor the following reactions at 1495 k? a. HBr(g) ↔
2(g)
+ Br2(g)
b. HBr(g) ↔ H2(g)+ Br2(g) c.
H2(g) + Br2(g) ↔HBr(g)
4. For the reaction 2NO (g) + 2H2(g) ↔ N2(g) + 2H2(g) It is determined that, at equilibrium at a particular temperature, the concentrations are as follows: [ NO(g) ] = 8,1 x 10-3 M, [H2(g)] = 4,1 x 10-5 M, [N2(g)] = 5,3 x 10-2 M. and [H2O(g)]= 2,9 x 10-3 M. Calculate the value of K for the reaction at this temperature. 5. At a particular temperature a 2,00-L flask at equilibrium contains 2,80 x 10 -4 mol N2, 2,50 x 10-5 ml O2, and 2,00 x 10-2 mol N2O. calculate K at this temperature for the reaction 2N2(g) + O2(g) ↔ 2N2O(g) If [N2] = 2.00 x 10-4 M, [N2O]= 0,200 M, and [O2]= 0,000245 M, does this represent a system at equilibrium? 6. At 1100 K, Kp = 0,25 for the reaction
2SO2(g) + O2(g) ↔ 2SO3(g) What is the value of K at this temperature? 7. The following equilibrium pressures were oserved at a certain temperature for the reaction N2(g) + 3H2(g)↔ 2NH3(g) PNH3 = 3,1 x 10-2 atm PN2 = 8,5 x 10-1 atm PH2 = 3,1 x 10 -3atm Calculate the value for the equilibrium constant Kp at this temperature. If PN3 = 0,525 atm ,PNH3 = 0,0167 atm, and PH2 = 0,00761 atm, does this reperesent a system at equilibrium? 8. The equilibrium constant is 0,0900 at 250C fror the reaction H2O(g) + Cl2O(g) ↔ 2HOCl(g) For which of the following sets of conditions is the system equilibrium ?for those which are not at equilibrium , in which direction will the system shift? a. A 1.0-L flask contains 1,0 molHOCl, 0,10 mol Cl2O, and 0,10 mol H2O b. A 2,0- L flask contains 0,084 molHOCl, 0,080 mol Cl2O, and 0,98 mol H2O c. A ,0-L flask contains 0,25 molHOCl, 0,0010 mol Cl2O, and 0,56 mol H2O. 9. For the reaction 2H2O(g)↔ 2H2(g) + O2(g) K = 2,4 x 10-3 at a given temperature. At equilibrium it is found that [H 2O(g)] = 1,1 x 10-1 M and [H2(g)] = 1,9 x 10-2 M. what is the concentration of O2(g) under these conditions? 10. The reaction 2NO(g) + Br2(g) ↔2NOBr(g) Has Kp = 109 at 250C. if the equilibrium partial pressure of Br 2 is 0,0159 atm and the equilibrium partial pressure of NOBr is 0,0768 atm, calvulate the partial pressure of NO at equilibrium. 11. At 350C, K = 1,6 x 10-5 for the reaction 2NOCl(g) ↔ 2NO(g) + Cl2(g) Calculate the concentrations of all species at equilibrium for each of the following original mixtures. a. 2,0mol pure NOCl in a 2,0-L flask. b. 1,0 molNOCl and 1.0 mol NO in a 1,0-L flask c. 2,0 molNOCl and 1,0 mol Cl2 in 1,0-L flask 12. Predict the shift in the equilibrium position that will occur for each of the following reactions when the volume of the reaction container is increased. a. N2(g) + 3H2(g) ↔ 2 NH3 (g) b. PCl5(g) ↔ PCl3(g) + Cl2(g) c. H2(g) + F2(g)↔ 2HF(g) d. COCl2(g) ↔ CO(g) + Cl2(g) e. CaCO3(s) ↔CaO(s) + CO2(g) 13. An important reaction in the commercial production of hydrogen is CO(g) + H2O(g) ↔ H2(g) + CO2(g) How will this system at equilibrium shift in each of the five following cases? a. Gaseous carbon dioxide is removed
b. Water vapor is added c. In a rigid reaction container, the pressure is increased by adding helium gas. d. The temperature is increased (the reactin is exothermic). e. The pressure is increased by decresing the volume of the reaction container. 14. The formation of glucose from water water and carbon dioxide is one of the more important chemical reactions in the world. Plants perform this reaction through the process of photosynthesis, creating the base of the food chain: 6H2O(g) + 6CO2(g)↔ C6H12O6(s) +6O2(g) At a particular temperature, the following equilibrium concentrations were found : [H2O(g)] = 7,91 x 10 -2 M, [CO2(g)] = 9,3 x 10-1 M, and [O2(g)] =2,4 x 10-3 M. calculate the value of K for the reaction at this temperature. 15. At a certain temperature, K = 9,1 x 10 -4 for he reaction FeSCN2+(aq) ↔ Fe3+ (aq) + SNC-(g) Calculate the concentrations of Fe3+, SNC-, and FeSCN2+ in a solution that is initially 2,0 M FeSCN2+. 16. Given the following equilibrium constants at 4270C, Na2O(s) ↔2Na(l) + O2(g)
K1 = 2 x 10-25
NaO(g) ↔ Na(l) + O2(/g)
K2 = 2 x 10-5
Na2O2(s) ↔2Na(l) + O2(g) K3 = 5 x 10-29 NaO2(s) ↔Na(l) + O2(g) K4 = 3 x 10-14 Determine the values for the equilibrium constants for the following reactions. a. Na2O(s) + O2(g) ↔ Na2O2(s) b. NaO(g) + NaO2(s) ) ↔ Na2O2(s) ↔ Na(l) c. 2NaO(g) ↔ Na2O2(s) (hint : when reaction equations are added, the equilibrium expressions are multiplied). 17. A sample of N2O4(g) is placed in an empty cylinder at 25 0C. after equilibrium is reached the totl pressure is 1,5 atm and 16% (by moles) of the original N 2O4(g) has dissociate to NO2 (g) a. Calculate the value of Kp for this dissociation reaction at 250C b. If the volume of the cylinder is increased until the total pressure is 1,0 atm ( the temperature of sytem remains constant), calculatethe equilibrium pressure of N2O4(g) and NO2(g) c. what percentage ( by moles) of the original N 2O4(g) is dissociated at the new equilibrium position (total pressure = 1,00atm )? 18. Hitung Kp pada 500 K untuk sistem 2HI(g)) ↔ H2(g) + I2(g) ,jika Kp pada 300 K adalah 2,16 x 10-3. Asumsikan harga ∆H0 tetap. Harga ∆H0 untuk reaksi di atas adalah 12500 kalori. 19. Jika diketahui data pada temperature 298K untuk ∆G 0f NH3 = -3976 kalori mol-1dan ∆H0f NH3 = -11,040 kkal. Mol-1.Hitung harga kp pada suhu 298 K untuk reaksi3H 2(g) + N2(g) ↔ 2NH3(g).
20. Dalam sebuah wadah dengan volume V liter terdapatsuatucampuran gas dalamkesetimbangan. Komposisicampuran gas ini : 2 mol PCL5, 2mol PCl3, dan Cl2. tekanan total dalam 3 atmpadasuhuT.denganmempertahankansuhudantekanantetap, sejumlah gas Cl2dimasukkankedalamwadahsehinggavolumenyamenjadi 2V liter. Semua gas dianggapideal .berapaumlahmol CL2 yang dimasukkan? 21. Tekananuapamoniapadasuhu -500C adalag 0,4034 atm, sementarapadasuhu 00Cadalah 0,42380 atm. Pertanyaan: a. Hitungentalpi molar penguapan (∆Hvap) dari ammonia b. Hitungsuhudidih normal NH3(l)
Pembahasan: 1. a. N2(g) + O2(g) ↔ 2NO2(g)
K= b. N2o4(g) ↔ 2NO2(g)
K= c.SiH4(g)+ 2Cl2(g)↔ SiCl4(g) + 2H2(g)
K= d.2PBr3(g) + 3Cl2(g) ↔ 2PCl3(g) + 3Br2(g) K=
2. solving from number 1 a. N2(g) + O2(g) ↔ 2NO2(g) b K= b.
N2o4(g) ↔ 2NO2(g) K=
c. SiH4(g) + 2Cl2(g) ↔ SiCl4(g) + 2H2(g) K = d. 2PBr3(g) + 3Cl2(g) ↔ 2PCl3(g) + 3Br2(g) K= 3. a. 17,5 x 104 b.3,5 x 104 c. 17,5 x 104
4. K=
=
=
= = 0,113 x 108 = 113 x 105 5. Kp =
=
= =0,4 x 109 = 4x108 6. Kp = Kc x R x T∆n 0,25atm = Kc x 0,082 atm.L/K.Mol x 1100 K 0,25 = Kc x 90,2-1 Kc = 2,77 x 10-2 7. N2(g) + 3H2(g)↔ 2NH3(g) Kp =
Kp =
Kp = Kp = 0,037951 x 106 = 37.951
8. Kp =
=
= 111,6
9. 2H2O(g)↔ 2H2(g) + O2(g)
K=
2,4 x 10-3 =
2,4 x 10-3 = [2,904 x 10-5 ]= [3,61 x 10-4 ]x [O2]
[O2] =
= 0,804x 10-1
10. Kp =
109 =
109 =
[NO]2 =
= 0,0584 atm
11. a. [NOCl] = 2,0 – (2 x 0,016) = 1,97 M= 2,0
[NO] = 0,032 M [Cl2] = 0,016 M b.[NOCl] = 1,0 – (2 x 1,6. 10-5) = 0,999968 M= 0,1 [NO] = 1,0 + (2 x 1,6. 10-5) = 1,0 M [ Cl2] = 1,6 x 10-5 M c.[NOCl] = 2,0 – (2x 4. 10-3) = 1,992 M M= 2,0 [Cl2] = 1 + 4.10-3 = 1 M [ NO] = 0,008M 12. a. If volume of the reaction container is increased so the equilibrium will shift left b.If volume of the reaction container is increased so the equilibrium will shift right c.If volume of the reaction container is increased so the equilibrium will shift left d. If volume of the reaction container is increased so the equilibrium will shift right e.If volume of the reaction container is increased so the equilibrium will shift right
to to to to to
13. a. shift to right b.shift to right c.no shift, helium gaseus is neither a reactan or product (inert gaseus) d.shift to left since there are the same number molecules on both sides of the reaction 14. Kp=
=
= =121,96 x 10-12 15. FeSCN2+ (aq) ↔ Fe3+ (aq) + SNC-(g) M 2M B xM xM xM S (2-x)M xM xM
Kc=
9,1 x 10 -4 = 9,1 x 10 -4 = X2 + 9,1.10-4 – 18,2.10-4 =0 X2 = 9,1x10-4 X= √9,1x10-4 X= 0,03 M So, [Fe2+] = x = 0,03M [SCN-] = x = 0,03M [FeSCN2+] = (2-x)M = (2 - 0,03 ) = 1,97 M 16. a.
.
(K1) =
2 x 10-25
= 0,4 x 10-4 = 4 x 103 b.
.
(K1)(K2) =
2 x 10-25) (2 x 10-5)
= 8 x 10-2 c.
.
(2K2)=
(2x 2 x 10-5)
= 8 x 1023
17. Kp =
=
18. Kp pada suhu 300K Kp = Kc (RT)∆n 2,16 x 10-3 = Kc (0,082 x 300K)0 Kc = 2,16 x 10-3 Kp pada suhu 500K Kp = Kc (RT)∆n Kp= 2,16x10-3 (0,082 x 500 K)0
Kp =2,16 x 10-3 19. ∆G0f = RT In Kp -3976 kalori mol-1 = 0,082 x 298 K In Kp -3976 kalori mol-1 = 24,436 In Kp Kp = -162,71
20. PCl5 ↔ PCl3 + PCl2 .
1.PV = nRT → V= = 2Rh 2. n=
=
=
= 12 mol
nCl2 = 12 mol – 6 mol = 6 mol 21. a.- n1=
-
=
n2=
NH3 →
= 0,0018 mol
= 0,0015 mol
=
N2 +
H2
M 0,0018 B 0,0015 S
0,0003 (3 x 10-4) Q= m x c x ∆T = 1 x 4,2 x 500C =210 j ∆H=
= 700 kJ b.Ttotal = T2 – T1 = 00 C – (-50) 0C = 500C Maka suhu normal adalah = 500C + 1000C = 1500C
TUGAS RUTIN BAB 3 HALAMAN 50 1. Bahan pembasmi nyamuk yang terkenal , DDT, mempunyai rumus molekul C 14H9Cl5. Dalam tubuh nyamuk DDT mengalami metabolisme dan menghasilkan DDD dengan susunan 52,5% C, 3,15%H, dan 44,4% Cl dengan berat molekul 320. Tentukan rumus empiris dan rumus molekul DDD! (Ar C = 12, Cl = 35,5 dan H = 1) Penyelesaian : Diketahui : CmHnOp RUMUS EMPIRIS m= = = 4,37 % = 4 (pembulatan)
n= = = 3,15 % = 3 (pembulatan) p= = = 1,25 % = 1 (pembulatan) Sehingga CmHnOp = C4H3O RUMUS MOLEKUL C4H3O = 340 48x + 3x +16 x = 340 67x = 340 x x x
= = 5,07 = 5 (pembulatan)
2. Pada pembakaran sempurna 18 gram senyawa karbon yang hanya terdiri dari unsur Karbon, Hidrogen dan Oksigen akan menghasilkan 26,4 gram karbon dioksida dan 10,8 gram air. Tentukan rumus empiris dari senyawa karbon tersebut! (Ar C = 12, O = 16 dan H=1) Penyelesaian : CXHYOZ + O2
CO2 + H2O
m CXHYOZ m CO2 m H2O
= 18 gram = 26,4 gram = 10,8
C dalam CO2
=
x m CO2
C dalam CO2
=
x 26,4 gram
C dalam CO2
= 7,2 gram
H dalam H2O
=
x m H2O
H dalam H2O
=
x 10,8 gram
H dalam H2O
= 1,2 gram
mO
= m CXHYOZ – ( m C + m H )
mO
=18 gram – (7,2 gram + 1,2 gram)
mO
=18 gram – ( 8,4 gram )
mO
= 9,6 gram
DALAM PERSEN C
=
C
=
C
= 40 %
H
=
H
=
H
= 6,6 %
O
=
O
=
O
= 53,3 %
x 100% x 100%
x 100% x 100%
x 100% x 100%
RUMUS EMPIRIS C
=
C
=
C
= 3,33
H
=
H
=
H
= 6,6
O
=
O
=
O
= 3,33
C 3,33 1 1
: : : :
H 6,6 1,98 2
: : : :
O 3,33 1 1
CH2O 3. Lengkapi koefisien reaksi dari reaksi berikut : a. Ag2S + HNO3
AgNO3 + S + NO2 + H2O
b. K4Fe(CN)6 + H2SO4 + H2O c. KMnO4 + H2SO4 + H2C2O4
K2SO4 + FeSO4 + (NH4)2SO4 + CO K2SO4 + MnSO4 + CO2 + H2O
Penyelesaian : d. 2 Ag2S + 3 HNO3
4 AgNO3 + S + 4 NO2 + 4 H2O
e. K4Fe(CN)6 + 6 H2SO4 + 6 H2O f.
2 K2SO4 + FeSO4 + 3 (NH4)2SO4 + 6 CO
2 KMnO4 + 3 H2SO4 + 5 H2C2O4
K2SO4 + 2 MnSO4 + 10 CO2 + 8 H2O
4. Tuliskan persamaan reaksi molekul dan reaksi ionik dari reaksi berikut : a. Kalium iodida dicampur dengan timbal nitrat b. Logam tembaga dilarutkan dalam larutan asam nitrat pekat c. Logam seng dicelupkan ke dalam larutan asam sulfat encer Penyelesaian : a) Reaksi molekul 2 KI + Pb(NO3)2
2 KNO3 + PbI2
Reaksi ionic Pb2+ + 2 NO32- + 2 K2+ + 2 I-
2 NO32- + 2 K2+ + PbI2
b) Reaksi Molekul Cu + 2 HNO3
Cu(NO3)2 + H2
Reaksi ionic Cu + 2 H+ + 2 NO3-
Cu(NO3) + 2 H+
c) Reaksi molekul 2 Zn + 2 H2SO4
Zn2(SO4)2 + 2 H2
Reaksi ionik 5. Kadar urea (CO(NH2)2 dalam suatu pupuk urea adalah 46%. Tentukan kadar nitrogen dalam pupuk urea tersebut! (Ar C=12, O=16 N=14 dan H=1) Penyelesaian : (CO(NH2)2 = 46% Mr = 60 %N
=
%N
=
%N
=
%N
= 21,5 %
6. Seorang petani ingin memupuk 1 hektar ladangnya dengan pupuk TSP sehingga tiap meter persegi ladang itu mendapat tambahan 1 gram fosfor. Jika kadar Ca(H 2PO4)2 dalam TSP adalah 98%. Hitung berapa kg pupuk TSP yang dibutuhkan oleh petani tersebut (Ar Ca=40, P=31, O=16 dan H=1) Penyelesaian : Untuk memupuk 1 ha (10.000 m2 ) maka, diperlukan massa nitrogen sebagai berikut. Massa nitrogen = 1,4 gram x 10.000 = 14.000 gram Maka massa urea yang dibutuhkan adalah Massa N
=
x massa CO(NH2)2
Massa CO(NH2)2 = Massa CO(NH2)2 = Massa CO(NH2)2 = 60.000 gram Massa CO(NH2)2 = 60 kg Jadi, massa urea yang dibutuhkan adalah 60 kg 7. Sebuah perusahaan pembangkit listrik menggunakan 6600 ton batubara per hari sebagai bahan bakar. Di dalam batubara tersebut kadar belerang sekitar 1,6% massa. Selain energi yang dihasilkan dari pembakaran batubara, belerang akan teroksidasi menjadi belerang dioksida yang merupakan salah satu sumber polusi udara, untuk mengurangi resiko lepasnya polutan ini ke udara, digunakan kalsium oksida sebagai penyerap sehingga terbentuk kalsium sulfit (Ar S=32, O = 16 dan Ca=40) dengan kemapuan daya serap kalsium oksida adalah sekita 85% massa belerang dioksida. Hitung berapa ton kalsium oksida yang dibutuhkan oleh perusahaan tersebut per hari! Answer m kalsium = 6600 x 85% m kalsium = 5610 w Ca
=
w Ca
=
x 5610
w Ca = 4.007 ton 8. Dalam proses Solvay, untuk menghasilkan natrium karbonat, Na 2CO3 reaksi berikut terjadi secara berurutan : NH3 + CO2 + H2O
NH4HCO3
NH4HCO3 + NaCl
NaHCO3 + NH4Cl
2 NaHCO3
Na2CO3 + CO2 + H2O
Berapa ton natrium karbonat akan diproduksi per ton NH 3, Jika proses itu 100% efisien ? Penyelesaian :
NH3 + CO2 + H2O
NH4HCO3
n NH3 = n NH3 = 58,8 n NH4HCO3 = 58,8 NH4 HCO3 + NaCl
NaHCO3 + NH4Cl
n NH4 HCO3 = 58,8 n NaHCO3 = 58,8 2 NaHCO3
Na2CO3 + CO2 + H2O
n NaHCO3 = 2 x 58,8 n NaHCO3 = 117,6 n Na2CO3 =
x 117,6
n Na2CO3 = 58,8 gram Na2CO3 = n x Mr Na2CO3 gram Na2CO3 = 58,8 x 106 gram Na2CO3 = 6.232,8 kg gram Na2CO3 = 6,2328 ton 9. Hitunglah jumlah gamping, CaO, yang akan dibuat dengan memanaskan 200 kg batu kapur yang mempunyai kemurnian CaCO3 95% ! Penyelesaian : CaCO3
CaO + CO2
Massa CaCO3 =
x 200
Massa CaCO3 = 190 Mol CaCO3
=
Mol CaCO3 = 1,9 Kmol Dengan perbandingan koefisien maka diperoleh Mol CaO = 1,9 Kmol Massa Cao = 1,9 x 56 Massa Cao = 106,4 gram 10. Kloropikrin dapat digunakan sebagai insektisida dengan biaya murah melalui proses yang menggunakan reaksi : CH3NO3 + 3 Cl2
CCl3NO3 + 3 HCl. Berapa banyak nitrometana
yang dibutuhkan untuk membuat 500 gram kloropikrin ? Penyelesaian : CH3NO3 + 3 Cl2
CCl3 NO3 + 3 HCl
n CCl3 NO3 = n CCl3 NO3 = n CCl3 NO3 = 2,8 Karena pebandingan koefisien antara CCl3 NO3 dengan CH3NO3 sama maka mol(n) sama
n CH3NO3
=
2,8
=
Gram CH3NO3 = 210 gram. 11. Sebotol zat Kalium Permanganat (KMnO4) tercapur dengan sedikit Kalium Klorida (KCl). Bila sebanyak0,586 gram KMnO4 yang tidak murni tersebut dilarutkan dalam basa, dan kemudian direaksikan dengan asam oksalat, Mn dalam contoh tersebut secara kuantitatif berubah menjadi Mangan Dioksida (MnO 2) seberat 0,297 gram. Berapa % berat KMnO 4 contoh diatas (Mr KMnO4 = 158, MnO2 = 87) Penyelesaian : KMnO4 + KCl
KMnO4 + KCl
gr= 0, 586 KMnO4 + C2H4 2MnO2 + K2CO3 + H2O + CO2 n gram
= 0,0034 = 0,0034 x 158 = 0,53720 gram
n 2MnO2
= = 0,5034
%
=
x 100%
%
= 1,09 %
12. Sebanyak 100 mL air garam yang berisi NaCl, direaksikan dengan perak nitrat berlebih menghasilkan 7,175 gram endapan perak klorida menurut persamaan : NaCl (aq) + AgNO3(aq)
AgCl (s) + NaNO3(aq)
Jika massa jenis air garam itu adalah 1,03 kg/L, hitung berapa persen kadar NaCl dalam air garam tersebut (Ar Na = 23; Cl = 35,5; Ag=108) Penyelesaian : Diketahui : P = 1,03 kg/L NaCl (aq) + AgNO3(aq) n AgCl
=
n AgCl
=
n AgCl
= 0,05 mol
AgCl (s) + NaNO3(aq)
M
=
M
=
M
= 5 x 10-4
M
=
5 x 10-4= %
=
%
= 550,3 %
13. Suatu campuran NaCl dan KCl bobotnya 5,4892 gram. Contoh itu dilarutkan didalam air dan direaksikan dengan larutan perak nitrat yang berlebih. AgCl yang terbentuk ditimbang, bobotnya 12,7052 gram. Berapakah persentase NaCl dalam campuran tersebut ? Penyelesaian : NaCl + KCl 5,4892 gram NaCl + KCl + AgNO3
AgCl + NaCl + KNO3
n
12,7052
= 5,4892 gram
% = % = 0,9 % 14. Pada banyak negara, seseorang secara hukum dinyatakan mabuk jika dalam darahnya tekandung etil alkohol ( C2H5OH) dengan konsentrasi 0,1 gram ( atau lebih) per desiliter. Nyatakan konsentrasi etil alkohol tersebut dalam satuan mol.L -1. Diketahui : [C2H5OH] = 0,1 g/ dL. Mr C2H5OH = 46. Ditanya : [C2H5OH] dalam mol/ L =……? Penyelesaian : [C2H5OH] = 0,1 g/ dL = 0,1 g/ 0,1 L = 1 g/ L. m = mol = g/ Mr = 1 g / 46 g/mol = 0,02 mol. Maka konsentrasi etil alkohol adalah 0,02 mol/ L.
15. Hitung berapa gram jumlah air yang harus ditambah pada 5,00 gram urea (CO (NH 2)2) untuk membuat larutan 16,2 % berdasarkan massa. Diketahui : m urea = 5 gram = 16,2 % Ditanya : g air =……? Penyelesaian : % m air = ( 100- 16,2 ) % = 83, 8% m air = m urea x %air/ % urea = 5 g x 83,8 % / 16,2 % = 5 g x 5,172 = 25, 86 g air. 16. Suatu larutan berair asam hidroklorida mengandung 38 % asam hidroklorida berdasarkan massa. Rapatannya ialah 1, 1886 g.cm -3 pada suhu 20 oC. hitunglah : a) molaritas larutan, b) molalitas larutan dan, c) fraksi mol asam hidroklorida Diketahui : m HCl = 38%, Mr HC l = 36, 5 HCl
= 1,1886 g.cm-3
T = 20 0 C Ditanya : a) M =………? b) m =………? c) XHCl =……? Penyelesaian : Massa larutan = 1000 ml x
HCl
= 1000 x 1,1886 = 1188,6 gram HCl dalam 1 L larutan = 38 % x 1188,6 = 451, 67 g. Mol HCl = g / Mr = 451, 67 / 36, 5 = 12, 37 mol Jumlah air dalam larutan ( m air ) = massa larutan – massa HCl = (1188,6 - 451, 67) g = 736,93 g m air = 0,73693 kg mol air
= g / Mr H2O = 736,93 / 18 = 40, 94 mol.
a) M = mol HCl/ 1 liter larutan = 12,37 / 1 = 12,37 M b) m = mol HCl / massa air = 12, 37 / 0,73693 = 16, 78 m c) XHCl = mol HCl / mol HCl + mol air = 12,37 mol / (12,37 + 40, 94 ) mol = 12,37 / 53, 31 = 0,23 .
17. seorang pasien memiliki “tingkat kolesterol” 214. Sebagaimana pengukuran kimia darah lazimnya, hasilnya dinyatakan dalam satuan mg.dL-1. Pertanyaan: a. tentukan molaritas kolesterol dalam darah pasien, jika massa molar kolesterol adalah 386,64 g.mol-1. b. perkirakan molalitas kolesterol dalam darah pasien, dan c. tentukan volume darah pasien yang dibutuhkan untuk memperoleh 8,10 gram kolesterol. Jawab: dik :
[kolesterol] = 214 ppm
Mr kolesterol = 386,64 g. Mol-1 Dit : a. [kolesterol] = ... b. m = ... c. V = ... Dij : a. 214 ppm = 214 mg kolesterol dalam 1 liter larutanya M=
=
=
= 0,00055 M
b. m = = = 0.55349 mol/kJ c. mol =
=
= 0,02 mol
mol = V . M 0,02 = V . 0,00055 V = 36,36 L 18. untuk menetapkan kadar asam sitrat yang terdapat dalam minuman, sebanyak 50 mL sampel minuman dititras dengan larutan NaOH 0,04166 M. Untuk mencapai titik ekivalen dengan menggunakan indikator fenolftalein, dibutuhkan larutan NaaOH sebanyak 17,62 mL. Hitung berapa %b/v kadar asam sitrat dalam minuman tersebut! Jawab : C6H8O7 + NaOH
Na3C6H8O7 + 3 H2O
Mol NaOH = V . M = 17,62 mL . 0,04166 M = 0,73 mmol = 7,3 . 10-4 mol 3 mol NaOH = mol C6H8O7 Mol C6H8O7 = 3 . 7,3 . 10-4 = 21,9 . 10-4 mol Massa C6H8O7
= Mr. Mol =192x21,9.10-4 = 0,42 gram
= 0,84 % 19. tuliskan persamaan yang menghubungkan Ka suatu asam dengan Kb basa konjugasinya. Gunakan NH3 dan NH4+ sebagai contoh! Jawab : H2O + NH3
NH4+ + OH-
20. Hitunglah pH dari larutan HCN 1.10-4M, bila diketahui pKa HCN=9,4. Pembahasan: Dik: Ka=9,4 Ma= 1.10-4 Dit: hitunglah pH larutan? Jawaban [H+]]= [H+]=
[H+]= [H+]=3,06. 10-2 M pH= -log[H+] = -Log 3,07 . 10-2 = 2-log 3,07
:
=2- 0,49 = 1,51 21. Hitunglah pH dari larutan NH4CL 0,02 M, bila diketahui Kb NH3= 1,8.10-5 Pembahasan: Dik: Kb= 1,8.10-5 2.10-2
M= 0.02M
Dit: hitunglah pH larutan? Jawaban
:
[OH-]= [OH-]=
[OH-]= [OH-]=
M
[OH-]=6.10-4 POH= -log[OH-] =-Log 6.10-4 = 4-log 3,07 =4- log 6 pH= 14-(4 –log6) = 10+ log 6 22. Sebanyak 4,1 gram natrium asetat, CH 3COONa(Mr=82) dilarutkan dalam air hingga volume larutan 500ml. Jika Ka CH 3COOH=10-5. Tentukan pH larutan dan persen hidrolisisnya! Pembahasan : m CH3COONa: 4,1 gram Mr CH3COONa: 82 gram/mol Volume larutan: 500 mL= 0,5 L Ka CH3COOH:10-5, Kw = 10-14 Dit: pH larutan dan persen hidrolisisnya ?
mCH3COONA =
=
=0,02 mol M CH3COONa=
= = 0,1 M
[OH-]=
=
= =10-8 POH= -log [OH-] = - log [10-8] = 8 Ph larutan= 14-POH =14 – 8 = 6 23. Suatu larutan buffer formiat dengan pH 4, dibuat dengan cara mencampurkan larutan HCOOH 0,2 M dengan larutan HCOONa 0,3 M . Jika K a HCOOH= 2.10-4, tentukan perbandingan volume HCOOH dan HCOONa dalam campuran. Penyelesaian: Jumlah mol HCOOH = 0,2 V1 Jumlah mol HCOONa = 0,1 V2 Nilai pH = 4
[H+] = 10-4
Ka HCOOH= 2.10-4
[H+] =
10-4 =
1 = V1 : V2 = 4:3 24. Ke dalam 50 mL larutan buffer yang terdiri dari campuran NH 3 0,2 M dan NH4Cl 0,1 M ditamvahkan 0,5 mL larutan HCl 0,1 M. hitung pH dari larutan buffer tersebut setelah penambahan asam pKa NH4+ = 9,26. Penyelesaian : [NH3] = 0,2 M [NH4] = 0,1 M V campuran = 50mL Sebelum penambahan HCl [H+] =
= 10-9,16
maka di peroleh pH = 9,16
Sesudah penambahan HCl [H+] =
= 10-909 maka diperoleh pH = 9,09
Maka pH setelah penambahan HCl = 9,16 – 9,09 = 0,07 25. Misalkan anda diminta membuat sistem buffer untuk darah tiruan dan menginginkan agar buffer tersebut mampu mempertahankan darah pada pH yang sebenarnya yaitu : 7,4. Jika hal-hal yang lainnya sama, manakah sistem buffer yang anda lebih sukai : H2CO3/HCO3- atau H2PO4-/HPO42-. Jelaskan! Penyelesaian : Pada cairan intra sel, kehadiran larutan buffer fosfat sangat penting dalam mengatur pH darah. Larutan buffer ini berasal dari campuran dihidrogen fosfat (H 2PO4-) dengan monohidrogen fosfat (HPO32-). Buffer fosfat dapat mempertahankan pH darah 7,4. Larutan buffer diluar sel hanya sedikit jumlahnya tetapi sangat penting untuk larutan penyangga urin. TUGAS RUTIN HALAMAN 10 (BELAKANG)
1. A solution of phosphoric acid was made by dissolving 10.0 g H 3PO4 in 100.0 mL water . The resulting volume was 104 mL.Calculate the density, mole fraction, molarity and molality of the solution. Assume water has a density of 1.00 g/cm 3. Diketahui : H3PO4 + H2O → H2PO4- + H3O + mH3PO4 = 10 g V1 = 100 mL = 10 L V2 = 104 mL AIR
= 1.00 g.cm-3
Ditanya : a)
=………?
b) X =………? c) M =…….…? d) m =………? Penyelesaian : n H3PO4 = g/ Mr = 10/ 98 = 0,1 mol AIR
= 1.00 g.cm-3 = 1 g. mL
m/ v = 1 g. mL m/ 100 mL = 1 g. mL m = 100 g n H2O = g / Mr = 100 g/ 18 g/mol = 5,5 mol. a)
=m/v
= 10 g/ 100 mL = 0,1 g/ mL b) X = n H3PO4 / n H3PO4 + n H2O = 0,1 / 0,1+ 5,5 = 0,017 mol c) M = m/ Mr x 1000/ v = 0,1 mol x 1000/ 100 =1M d) m = mol H3PO4 / massa berat = 0,1 mol / 0,1 = 1 m. 2. An aqueous antifreeze solution is 40 % ethylene glycol ( C 2H6 O2) by mass. The density of the solution is 1.05 g/cm -3. Calculate the molality, molarity and mole fraction of the ethylene glycol. Diketahui : mC2H6 O2= 40 % = 1, 05 g/cm Ditanya : a) m =………? b) M =…….…? c) X =………? Penyelesaian : Massa larutan = 1000 ml x
= 1000 x 1,05 = 1050 gram C2H6 O2dalam 1 L larutan = 40 % x 1050 = 420 g. Mol C2H6 O2 = g / Mr = 420 g / 62 g/ mol = 6, 77 mol Jumlah air dalam larutan ( m air ) = massa larutan – massa C 2H6 O2 = (1050 - 420 ) g = 630 g m air = 0,63 kg mol air
= g / Mr H2O = 630 / 18 = 35 mol. a) m = mol C2H6 O2 / massa air = 6, 77 mol / 0,63 = 10, 74 m b) M = mol C2H6 O2 / 1 liter larutan = 6, 77 mol / 1L = 6,77 M c) X = mol C2H6 O2 / mol C2H6 O2+ mol air = 6, 77 / 6, 77 + 35 = 6,77 / 41,77 = 0,162 3. The lattice energy*of Nal is -686 kj/mol, and the enthalpy of hydration is -694 kj/mol. Calculate the enthalpy or solution per mole of solid Nal. Describe the process to which this enthapy change applies. Answer : = - 604 kJ/mol = - 694 kJ/mol Dit :
=.......?
=(
)+(
)
= 694+604 =1294 kj/mol 4. Although AI(HO)3is insoluble in water, NaOH is very soluble. Explain in terms of lattife energies. Answer : AI(0H)3 has a-3 charge NaOH has a-1 charge The NaOH has a weaker lattice energy so it would be easier for hydration to occur. For AI(OH)3 it has a stronger lattice energy so it will be harder for hydration to accour.
5. Which solvent water or carbon tetracloride, would you choose to dissolve each of the following ? a. KrF2b
b. MgF2 c. SF2 d. CH2O
e.SO2
f. CH2PCH2
g.CO2
Penyelesaian : When you draw the Lewis Structure for SF 2 you come up with a bent shaped molecule. This tells you that it is a polar covalent molecule and that it would dissolve better in water. CO2 on the other hand is a non-polar covalent molecule (It's shape is linear based on it's Lewis structure). This means that it will be more soluble in CCl4. 6. The solubility of nitrogen in water is 8,21.10 -4mol/L at 00C when the N2 pressure above water is 0,709 atm. Calculate the Henry’s law constant for N 2 in units of mol/L. atm for henry’s law the form C=kP, where C is the gas concentration in mol/L. Calculate the solubility of N2 in water when the partial pressure of nitrogen above water is 1.10 atm at 00C. Penyelesaian: 8,21 x 10-4 = 0,79 x k K=
= 1,03 x 10-2
C = k. 1,10 atm C = 1,03 x 10-2 . 1,10 atm C = 1,133 x 10-2 2) calculate the solubility of O2 in water at a partial pressure of O 2 of 120 torr at 25°C. The Henry’s law constant for O 2 is 1,3 . 10-3 mol/L.atm for Henry’s law in the form C = kP, where C is the gas concentration (mol/L). Jawab : Diketahui : P = 120 atm = 120 torr
T = 25°C
K = 1,3 . 10-3 mol/atm
Ditanya : C = [O2] = kP C = 1,3 . 10-3 . 120 C = 156 . 10-3 6. Glycerin, C3H8O3, is a nonvolatile liquid,. What is the vapor pressure of a solution made by adding 164 g glycerin to 338 Ml H2O at 39, 8 0C? The vapor pressure of pure water at 39, 8 0C is 54.74 torr and its density is 0,992 g/cm3. Jawab : Diketahui :
mt = 164 gram T = 39,80C air
Vp = 338 mL Pp = 54,74 atm
= 0,992 g/cm3
Mr air = 18
Mr C3H8O7 = 92 Ditanya : PL = ... Dijawab : PL = Xp . Pp =
. Pp
=
. 54,74
= 54,22 atm 7. The vapor pressure of a solution containing 53.6 g glycerin ( C 3 H8 O3) in 133.7 g ethanol ( C2 H5 OH ) is 113 torr at 40 oC. Calculate the vapor pressure of pure ethanol at 40 o C assuming that glycerin is a nonvolatile, nonelectrolyte solute in ethanol. Diketahui : mt C3 H8 O3 = 53.6 g, Mr C3 H8 O3 = 92 mp = 133.7 g, Mr C2 H5 OH = 46 P ( C2 H5 OH ) = 113 atm T= 40 oC. Ditanya : ΔP = ... Penyelesaian : ΔP = P0 Xt
ΔP = 113 .
ΔP = 113 . 0,166 ΔP = 18,78 atm 8. The normal boiling point of methanol is 64,70C. A solution containing a nonvolatile solute dissolved in methanol has a vapor pressure of 710.0 torr at 64,7 0C. What is the mole fraction of methanol in this solution? Penyelesaian: Tekanan parsial methanol tergantung padafraksi molnya. Tekanan uap methanol pada titik dididh normal adalah 760 torr. Maka : P(methanol) = X(methanol). P(murni) X(methanol)=
X(methanol)=
= 0,091
9. At a certain temperature the vapor pressure of benzene C 6H6 is 0.930 atm. A solution was prepared by dissolving 10.0 g of a nondissociating, nonvolatile solute in 78.11 g of benzene at that temperature. ? The vapor pressure of the solution was found to be 0,900 atm. Assuming the solution behaves ideally, determine the molar mass of the solute. Jawab : Diketahui : Pp = 0,930 atm mt = 10,0 gram PL = 0,9 atm mp = 78,11 gram Mrp = 78 Ditanya : Mrt = ... Dijawab: PL = Xp . PP 0,9 =
. 0,930 = =
=
-
= Mr =
= 299,87
11. A solution is made by dissolving 25,8 g urea (CH 4N2O), a nonelectrolyte, in 275 g water. Calculate the vapor pressures of this solution at 25 is 23,8 torrr at 25
and 45
and 71,9 torr at 45
Answer n H2O
=
V
=
n H2O
=
0,275
=
n H2O
= 15,27
P
=
V
=
P
= 204,8
( the vapor pressure of pure water
0,275
=
P
=
P
= 113,8
12. a solution is prepared by dissolving 27 g urea, (NH 2)2CO, in 150 g water. Calculate the boiling point of the solution. Urea is a nonelectrolyte. Answer m=
m=
x
x
m=3
∆Tb = Kb.m
∆Tb = 0,09 . 3 ∆Tb = 0,27
13. A 2 g sample of a large biomolecule was dissolved in 15 g carbon tetrachloride. The boilng point of this solution was determined to be 77,85
. Calculate the molar mass of the biomolecule.
For carbon tetrachloride, the boiling-point constant is 5,03
kg/mol, and the boiling-point of pure
carbon tetrachloride is 76,50 Answer n =
5,03 =
Mr = Mr = 0,39 x 77,85 Mr = 30,36 14. what mass of glycerin (C 3H8O3), a nonelectrolyte, must be dissolved in 200 g water to give a solution with a freezing point of -1,50 Answer Tf = - 1,50 ◦C
?
∆Tf = Tf – T’f = 0 – (- 1,50) = 1,50 ◦C Kf = 1,86 ◦C/ m ∆Tf = m . Kf 1,50 = ( m/Mr x 1000/mair) x 1,86 1,50 = ( m/92 x 1000/200) x 1,86 1,50 = (m/92 x 5) x 1,86 1,50 =( 5m/ 92 ) x 1,86 138 = 9,3 m m
=
m = 14, 83 gr 15. The freezing point of t-butanol is 25.50
and Kf is 9,1
.kg/mol. Usually t-butanol absorbs
water on exposure to air. If the freezing point of a 10 g sample of t-butanol is 24,59
, how many
grms of water are present in the sample? Answer ΔTf = Kf x m x i ΔTf = Kf x m 0,91ºC = (9,1 ºC * kg / mol) x m m = 0,10 mol / kg Jadi ada sepersepuluh satu tetes air hadir untuk setiap kilogram pelarut. Jumlah zat terlarut awalnya hadir adalah 10,9 g, atau 0,0109 kg. 0,10 m = (mol) / (0,0109 kg) (mol) = 1,1e-3 mol Sekarang kita hanya mengubah mol air menjadi gram air, menggunakan massa molar air, yaitu 18,02 g / mol. 1.1e-3 mol x (18,02 g) / (1 mol) = 2,0e-2 g H2O. 16. calculate the freezing point and boiling point of an antifreeze solution that iss 50% by the mass of ethylene glycol (HOCH2CH2OH) IN WATER. Ethylene glycol is a nonelectrolyte.
Answer Moles = 50 g / 62 g/mol= 0.806 m = 0.806 / 0.050 Kg = 16.1 delta T = 16.1 x 1.86 = 29.9 freezing point = - 29.9 *C delta T = 16.1 x 0.512 = 8.24 boiling point = 108.24 °C 17. what volume of ethylene glycol (C2H6O2), a nonelectrolyte, must be added to 15 L water to produce an antifreeze solution with a freezing point -25
? what is the boiling point of this
solution ? (the density of ethylene glycol is 1,11 g/cm 3, and the density of water is 1 g/cm3.) Answer Rumusnya adalah delta T = i m K di mana saya adalah nomor van'tHoff, dalam hal ini 1 karena itu adalah nonelectrolyte; m adalah molalitas dalam tahi lalat / Kg; dan K adalah titik depresi titik beku konstan untuk air yang -1,86. Delta T = -25 derajat, jadi pecahkan untuk m; m = -25 / -1,86 = 13,44 molal Ini berarti 13,44 mol / Kg dan Anda memiliki 15 L yang = 15 Kg sehingga Anda memiliki 13,44 mol / Kg x 15 Kg = 201,6 mol. Massa molar dari ethylene glycol adalah 62gm / mol sehingga 62gm / mol x 201.6 mol = 12499 gram. density = 1.11gm / ml sehingga 12499gm / 1.11gm / ml = 11260 ml diperlukan. Gunakan rumus yang sama untuk mendapatkan titik didih tetapi gantikan nilai K = 0,512 18. From the following: Pure water, solution of C11H22O11 (m = 0,01) in water, solution of NaCl (m = 0,01) in water, solution of CaCl2 (m = 0,01) in water, choose the one with the a. highest freezing point. b. lowest boiling point. c. lowest freezing point , d highest osmotic pressure, e. highest boiling point. Answer Pertimbangkan solusi berikut. I. air murni II. larutan C12H22O11 (m = 0,01) dalam air larutan NaCl (m = 0,01) dalam air IV. larutan CaCl2 (m = 0,01) dalam air (a) Pilih yang memiliki titik beku tertinggi. air murni Solusi C12H22O11 Larutan NaCl Larutan CaCl2
(B) Pilih satu dengan titik beku terendah. air murni Solusi C12H22O11 Larutan NaCl Larutan CaCl2 (C) Pilih satu dengan titik didih tertinggi. air murni Solusi C12H22O11 Larutan NaCl Larutan CaCl2 (D) Pilih satu dengan titik didih terendah. air murni Solusi C12H22O11 Larutan NaCl Larutan CaCl2 (E) Pilih satu dengan tekanan osmotik tertinggi. air murni Solusi C12H22O11 Larutan NaCl Larutan CaCl2 19. calculate the freezing point and the boiling point of each the following solution : (assume complete dissociation.) a. 50 g NaCl in 25 g H2O, b. 2 g Al(NO3)3 in 15 g H2O Answer Untuk penggunaan depresi titik beku: ΔT = i Kf m Untuk penggunaan elevasi titik didih: ΔT = i Kb m Penjelasan variabel: ΔT = depresi titik beku. i = van't Hoff factor = jumlah partikel yang berasal dari masing-masing unit rumus. Kf = titik beku depresi konstan. Kb = konstanta elevasi titik didih. m = molalitas = mol terlarut / pelarut kg. NaCl berdisosiasi menjadi ion Na ^ + dan Cl ^ - i jadi i = 2 Al (NO3) 3 berdisosiasi menjadi 1 ion Al ^ 3 + dan 3 NO3 ^ - ion jadi saya = 4 Kf untuk H2O = 1,858 ° C / m Kb untuk H2O = 0,521 ° C / m tahi lalat NaCl = (5,0 g) / (58,44 g / mol) = 0,0856 mol Moles Al (NO3) 3 = (2,0 g) / (212,996 g / mol) = 0,00939 mol molality NaCl = (0,0856 mol) (0,025 kg) = 3,424 molal molality Al (NO3) 3 = (0,00939 mol) / (0,015 kg) = 0,626 molal
Untuk NaCl: ΔT = i Kf m = (2) (1,858 ° C / m) (3,424 m) = 12,7 ° C ΔT = Tf (pelarut murni) - Tf (solusi) 12,7 ° C = 0,0 ° C - Tf (solusi) Tf (solusi = -12,7 ° C Untuk Al (NO3) 3 gunakan i = 4. Metode perhitungan akan sama. Untuk NaCl: ΔT = i Kb m = (2) (0,521 ° C / m) (3,424 m) = 3,57 ° C ΔT = Tb (solusi) - Tb (pelarut murni) 3,57 ° C = Tb (solusi) - 100,00 ° C Tb (solusi) = 103,57 ° C 20. A Water desalination plant is set up near a salt marsh containing water that is 0,1 M Calculate the minimum pressure that must be applied at 25
to purify the water by reverse
osmosis. Assume NaCl is completely dissociated. Answer The osmotic pressure of a dilute solution can be approximated using the morse equation. ∏= iMRT Where i is the dimensionless van’t Hoff factor M is the molarity R= 0,08206 L. atm. Mol-1. K-1 is the gas Constant T is the thermodynamic (absolute) temperature For NaCl, i= 2, therefore ∏= 2 x 0,1 x 0, 08206 x ( 25 + 273 . 15 ) = 4,9 atm
NaCl.
BAB IV TERMODINAMIKA KIMIA LATIHAN SOAL HAL 56 1. Sebuah penangas listrik menghasilkan kalor sebesar 15 kkal perubahan energi dalam sebesar kJ. Berapakah kerja yang bekerja pada sistem tersebut. Penyelesaian : Dik : Sistem adalah penangas listrik Q = - 62,802 kJ (membebas kalor) ; 1kkal = 4,184 kJ U = 32 kJ Dit :W ? Jawab : U = Q + W W= U–Q W = 32 – (-62,802) W= 94,802 kJ 2. Satu mol gas sempurna dipanaskan sehingga sistem menyerap kalor sebesar 30 kJ, sekaligus melakukan kerja terhadap lingkungannya sebesar 45 kJ. Berapakah harga perubahan energi dalam. Penyelesaian: Dik :Q = 30 kJ ( menyerap kalor) W = - 45 kJ (melakukan kerja) Dit : U? Jawab : U = Q + W U = 30 + (-45) kJ U= - 15 kJ LATIHAN SOAL HAL 61 1. 50 ml larutan HCl 0,1 M pada temperature 25 NaOH 0,1 M pada temperature 25
dicampurkandengan 25 ml larutan
dalam beaker plastik. Hasil pencampuran
memiliki temperatur 32
, bila diketahui cair = 4,18 J/gr
. Berapakah harga kalor
penetralan? Penyelesaian : Dik : V HCl = 50 ml
t1 = 25
M HCl = 0,1 M
t2 = 32
mol HCl = 5 mmol
cair = 4,185 J/gr
Dit
V NaOH = 25 ml M NaOH = 0,1 M mol NaOH = 2,5 mmol : H?
Jawab : Vcamp = V HCl + V NaOH
mcamp = V
1 g/ml
= 50 ml + 25 ml
= 75 ml
= 75 ml
= 75 g
T = (t2 – t1)
1g/ml
= (32 - 25) =7
Q=m.c. T = 75 g . 4,18 J/g
.7
= 2194,5 J = - 2194,5 J (eksoterm) HCl(aq) + NaOH(aq) M= B = S =
5 mmol 2,5 mmol 2,5 mmol 2,5 mmol 2,5 mmol -
H = -2194,5 :
NaCl(aq) + 2,5 mmol 2,5 mmol
H2O(l) 2,5 mmol 2,5 mmol
= -877.800 J = - 877,8 kJ
2. 50 ml larutan CH3COOH 0,1 M pada temperatur 27 larutan KOH 0,05 M pada temperature 26 pencampuran memiliki temperatur 30
dicampurkan dengan 50 ml
dalam beaker plastik. Hasil
, bila diketahui cair = 4,18 J/gr
harga kalor penetralan? Penyelesaian : Dik : V CH3COOH = 50 ml
t1 = 27
M CH3COOH = 0,1 M
t2 = 30
mol CH3COOH = 5 mmol
cair = 4,18 J/gr
V KOH = 50 ml
. Berapakah
Dit
M KOH = 0,05 M mol NaOH = 2,5 mmol : H?
Jawab : Vcamp = V CH3COOH + V KOH
mcamp = V
1 g/ml
= 50 ml + 50 ml
= 100 ml
= 100 ml
= 100 g
1g/ml
Q=m.c. T = 100 g . 4,18 J/g
. (30 – 26,5)
= 1463 J CH3COOH(aq) + KOH(aq) M= B = S =
5 mmol 2,5 mmol 2,5 mmol
H = 1463 :
CH3COOK(aq) +
2,5 mmol 2,5 mmol -
2,5 mmol 2,5 mmol
H2O(l) 2,5 mmol 2,5 mmol
= -585.200 J = - 585,2 Kj
3. 2 gr logam Mg dilarutkan dalam 50 ml larutan HCl 1 M menghasilkan gas H2 dengan temperatur awal 29
dan temperatur akhir 35
bila diketahui cair = 4,18 J/gr
.
Berapakah harga kalor pembentukan gas? Penyelesaian: Dik : Mg = 2 gr
cair = 4,184 J/gr
HCl 1 M = 50 ml T=6
menghasilkan gas H2
Dit : Q kalor pembentukan gas? Jawab : Q = m . c . T = (50+2) . 4,18 . 6 = - 1,304 J 4. Seorang siswa mencampurkan 50 ml larutan HCl 1,0 M dan 50 ml NaOH 1 M dalam calorimeter yang kapasitas panasnya dapat diabaikan . Setelah reaksi , ternyata suhu larutan naik dari 21,0
menjadi 27,5
. Bila densitas larutan adalah 1,0 g/ml dan
-1
panas spesifik larutan adalah 4,18 J.g .K-1, maka hitunglah entalpi reaksi netralisasi tersebut. Penyelesaian : Dik : 50 ml HCl 1,0 M 50 ml NaOH 1,0 M
Densitas larutan = 1,0 g/ml cair = 4,18 J.g-1.K-1
T = 6,5 Dit
: H netralisasi?
Jawab :
NaOH + HCl
NaCl + H2O
nNaOH = M . V
nNaOH = nH2O 0,05 mol = 0,05 mol
= 1 . 0,05 = 0,05 mol
Q=m.c. T = 100 . 4,18 . 6,5 = - 2717 J ( eksoterm ) H=
=
= 54.340 J/mol = 54,34 kJ/mol
5. Dalam calorimeter bom yang kapasitasnya panasnya 2,71 kJ/ , sebanyak 1 gram metanol cair , CH3COH dibakar dengan gas oksigen dan menghasilkan gas CO2 dan H2O cair. Setelah reaksi selesai, suhu 2000 gram air naik dari 26 Diketahui panas spesifik = 4,184 J.g-1.
menjadi 33
-1
, tentukan nilai U reaksi untuk :
a. 1 gram metanol b. 1 mol metanol Penyelesaian : Dik
: C = 2,71 kJ/ metanol = 1 gr
Dit
T=7 cair = 4,184 J.g-1.
-1
mair = 2000 gr : U untuk a. 1 gram metanol b. 1 mol etanol
Jawab : Q = Q(kalorimeter) + Q(larutan) = (C. T) + (m . c . T) = ( 2,71.7) + (2000 . 4,184 . 7) = 18,97 + 58,576 = - 58594,97 kJ (eksoterm) a.
U 1 gram metanol U=Q = - 58594,97 kJ
b. U 1 mol metanol U = - 58594,97 kJ/g . 32 g/mol = - 1875039,04 kJ/mol
.
6. Dalam kalorimeter bom yang kapasitas panasnya 2,71 kj/
, sebanyak 4 gram
glukosa C6H12O6, dibakar dengan gas oksigen dan menghasilkan gas CO2 dan H2O cair. Setelah reaksi selesai, suhu 1000 gram air naik dari 27 Diketahui panas spesifik air = 4,184 J.g-1.
menjadi 37 .
-1
, tentukanlah nilai U reaksi
pembakaran tersebut! Penyelesaian : Dik
: C = 2,71 kJ/ mglukosa = 4 gr
Dit
T = 10 cair = 4,184 J.g-1.
-1
mair = 1000 gr : U reaksi pembakaran ?
Jawab : Q = Q(kalorimeter) + Q(larutan) = (C. T) + (m . c . T) = ( 2,71.10) + (1000 . 4,184 . 10) = 2,71 + 41840 = - 41,86 J nglukosa =
U=
= 0,02 mol
= 2.093 J/mol = 2,093 kJ/ mol
LATIHAN SOAL HAL 64 1. Berdasarkan data-data perubahan entalpi pembentukan standar yang dikemukakan dalam tabel tentukan perubahan entalpi reaksi standar untuk reaksi : Na(s) + H2O(l) NaOH(aq) + H2(g) Pembahasan : Dik : H0f Na = 0 kJ/mol H0f H2O(l) = -285,8 kJ/mol H0f NaOH(aq) = -426,8 kJ/mol H0f H2(g) = 0 kJ/mol Dit :
H0f reaksi …?
Jawab :
H0f =
H0f produk - H0f reaktan
= (-426,8 kJ/mol+0 kJ/mol)- (0 kJ/mol+(-285,8 kJ/mol)) = -426,8 kJ/mol – (-285,8 kJ/mol)
= -141 kJ/mol 2. Berdasarkan data-data perubahan entalpi pembentukan standar yang dikemukakan dalam tabel tentukan perubahan entalpi reaksi standar untuk reaksi : K(s) + H2O(l) KOH(aq) + H2 (g) Pembahasan : Dik : H0f K(s) = 0 kJ/mol H0f H2O(l) = -241,8 kJ/mol H0f H2(g) = 0 kJ/mol H0f KOH = Tidak diketahui H0f reaksi
Dit :
Jawab : Tidak dapat diselesaikan karena tidak dicantumkan tabel ataupun saat disearching tidak ada yang mencantumkan tabel secara lengkap. 3. Dari entalpi reaksi berikut ini : 2SO2(g) + O2 2SO3(g) H = -196 kJ 2S(s) + 3O2(g)
2SO3
H = -790 kJ
Berapakah perubahan entalpi pembentukan ( Hf) SO2? Jawab : Tidak dapat diselesaikan karena tidak dicantumkan tabel ataupun saat disearching tidak ada yang mencantumkan tabel secara lengkap. LATIHAN SOAL HAL 65 1. Berdasarkan data-data perubahan entalpi pembentukan standar yang dikemukakan dalam tabel tentukan perubahan entalpi reaksi standar untuk reaksi : C2H2(g) + O2(g) CO2(g) + H2O(l) Pembahasan : Dik : H0f C2H2(g) = +227 kJ/mol H0f O2(g) = 0 kJ/mol H0f CO2(g) = -393,5 kJ/mol H0f H2O(l)= -285,8 kJ/mol Dit :
H0f reaksi …?
Jawab :
H0f =
H0f produk - H0f reaktan
= (-393,5 kJ/mol+ (-285,8 kJ/mol)) - (+227 kJ/mol + 0 kJ/mol) = -679,3 kJ/mol – 227 kJ/mol) = -906,3 kJ/mol
2. Sebanyak 7,2 glukosa C6H12O6 (M=180 g/mol) dibakar sempurna dengan oksigen. Panas yang dihasilkan dari pembakaran tersebut dapat menaikkan suhu 1000 cm3 air sebesar 3,210C. Hitunglah entalpi pembakaran,
Hc glukosa bila diketahui kalor
spesifik , c H2O= 4,2 JK-1g-1 dan densitas air = 1g/cm3) Pembahasan : Dik : m glukosa = 7,2 g C6H12O6 (180 g/mol) T = 3,21
= 3,21 K
C H2O = 4,2 JK-1g-1 Densitas air = 1 g/cm3 Dit : Hc glukosa = …..? Jawab : C6H12O6 + 6O2
6CO2(g) + 6H2O(l)
7,2 g glukosa =
= 0,04 mol
qp = m . C . T = 1000 cm3 .
.
.
3,21 K
= 13.482 J = 13,482 kJ Hc glukosa = (1mol/0,04 mol) . 13,482 kJ = 25
13,482 kJ
= 337,05 kJ/mol = -337,05 kJ/mol 3. Entalpi pemabakaran fruktosa, C6H12O6 (M=180 g/mol) adalah -2812 kJ/mol. Bila 1 buah apel yang beratnya 120 g, rata-rata mengandung 15%(berat) fruktosa. Tentukan jumlah kalor yang dapat dihasilkan oleh 5 buah apel! Pembahasan : Dik : C6H12O6 CM = 180 g/mol Hc C6H12O6 = -2.812 kJ/mol 1 buah apel = 120 g terdapat 15% fruktosa Dit : Q 5 buah apel = ……? Jawab : Dalam 1 buah apel yang neniliki berat 120 g mengandung 15% fruktosa. Berat fruktosa = 120 15% = 18 g Terdapat 5 buah apel Berat fruktosa dalam 5 apel = 18 g mol fruktosa = n = Hc = n
Q
=
5 = 90 g
= 0,5 mol
-2.812 kJ/mol = -2.812 kJ/mol = 2 Q= Q = -1.406 kJ
Q Q
7. tetapan laju untuk reaksi kedua, reaksi: 2NOBr(g) .
. Pada suhu 10
2NO(g) +
(g) adalah 0,80
. Jika dimulai dengan konsentrasi NOBr sebesar 0,086 M.
hitunglah Konstrasi NOBr sesudah 22 detik Penyelesaian:
lnAt = -17,6 . 0,086 lnAt = -1,51366 lnAt = ln -1,51366 At = 0,4144 M 8. Energi pengaktifan (Ea) untuk isomerisasi siklopropana menjadi propilena, merupakan reaksi orde satu, adalah 272
. pada 50
, tetapan laju reaksi adalah 6,1 x
Pertanyaan: a) Hitung Faktor A (tetapan Arrhenius) untuk reaksi ini: ln k = ln A -
ln
.
b) Hitung Tetapan laju untuk reaksi 25 50 25
=
L.
9. tetapan laju untuk reaksi orde kedua: 2 pada 300 konsentrasi
(g)
2NO(g) +
(g) adalah 0,54
. Berapa lama waktu (dalam detik)yang diperlukan agar
turun dari 0,62 M menjadi 0,28 M.
Penyelesaian: 2
(g)
2NO(g) +
(g)
ln 0,4516 = - 0,54 . t - 0,7949 = - 0,54 . t t = 1,4720 s 10. perhatikan tahap elementer berikut: X + 2Y a. Tuliskan hukum laju reaksi ini. b. Jika laju awal Pembentukan
adalah 3,8 x
M.
dan konsentrasi awal
X dan Y masing masing adalah 0,26 M dan 0,88 M. tentukan tetapan laju reaksinya.
k = 18,9 x
11. perhatikan reaksi berikut: X + Y
XY
Jika X dan Y direaksikan dengan perbandingan mol yang sama, maka setelah reaksi berlangsung 1 jam, sebanyak 75% zat X telah bereaksi. Jika reaksi berorde nol tehadap zat Y dan berorde satu terhadap X, maka tentukan nilai k. Penyelesaian:
1 = 1500 k k=
12. Dalam mengkaji reaksi piridina
M.
dengan metil iodide
dalam larutan
Benzena, berikut ini adalah dat laju reaksi awal yang diukur pada suhu 25
untuk
berbagai konsentrasi awal dari dua reaktan Laju (M. 1,00 x
1,00 x
7,5 x
2,00 x
2,00 x
3,0 x
2,00 x
4,00 x
6,0 x
)
Pertanyaan: a. Tuliskan hukum laju reaksi tersebut. b. Hitunglah tetapan laju dan berikan satuannya
c. Ramalkan laju reaksi awal untuk larutan dengan 2,0 x
M. :
= 5,0 x
M dan
=
13 Menurut perkiraan dalam setiap kenaikan suhu sebesar 10 oC, laju reaksi akan meningkat dua kali. Jika suatu reaksi berlangsung pada suhu t oC, suatu reaksi berlangsung selama 12 menit. Hitung waktu yang dibutuhkan reaksi tersebut jika suhunya diubah menjadi (t+30)OC. JAWAB : DIK: n = 2 i = 10oC T1= toC t 1= 12 menit T2 = 30OC DIT: t2=….? PENYE: ∆T = t + 30 – t t 1/t 2 12/t 2 12/t 2 12/t 2 8t2 t2 t2 t2
= n(∆T/i) = 2(30/10) = 23 =8 = 12 = 12/8 = 1,5 menit = 90 detik
1. Salah satu tokoh yang dikenal dalam perkembangn senyawa organik adalah Friedhrich Wohler. Jelaskan penemuan Friedrich Wohler dalam perkembangan kimia orgnik. Jawab : pada tahun 1828 wohler mendapat hasil yang tak disangka saat mencoba mengkristalisasi garam anorganik NH4CNO dari larutannya, iya tidak sengaja memproduksi senyawa organik yang telah diketahui yaitu urea, senyawa dari air seni.
2. Mengapa sampai saat ini istilah senyawa organik dan anorganik masih dipertahankan, walaupun pada hakikinya tidak ada perbedaannya. Jawan : karena dengan menggunakan istilah senyawa organik dan senyawa anorganik hal ini dapat untuk membedakan semua senyawa yang berasal dari mineral.
3. Deskripsikan perbedaan zat organik dan anorganik Jawab : zat organik adalah zat yang kebanyakan berasal dari makhluk hidup, yang senyawanya mudah terbakar, memiliki struktur yang rumit, yang mengandung unsur karbon, dan hanya dapat larut dalam pelarut organik contohnya CH4, C2H5OH, C2H6 dsb, sedangkan senyawa anorganik yaitu senyawa yang berasal dari alam mineral ( bukan makhluk hidup ), tidak mudah terbakar, sturktur sederhana, tidak semua senyawa anorganik memiliki unsur karbon, dan dapat larut dalam pelarut air atau organik contohnya NaF, NaCl, NaBr, Nal dsb. 4. Tuliskan skematik pembagian hidrokarbon Jawab : HIDROKARKON
ALIFATIK
JENUH ALKANA
SIKLIK
TIDAK JENUH
5. Jelaskan mengapa senyawa organik berikatan dengan ikatan kovalen bukan dengan ikatan ion. ALKENA
ALKUNA
ALISIKLIK
AROMATIK
Jawab: Kedua buah atom yang tergabung didalam ikatan ion memiliki perbedaan elektronegativitas yang besar, dimana ikatan ion sendiri menghasilkan ion positif dan juga ion negatif yang berpisah. Adapun muatan ion tersebut biasanya berkisar antara -3 elektro sampai dengan +3 elektron. Pada umumnya ikatan ion terjadi pada atom-atom dengan energi ionisasi paling rendah dengan atom-atom dengan afinitas elektron besar. Berbeda dengan ikatan kovalen yang mana atom-atom yang berikatan dalam ikatan tersebut memiliki perbedaan elektronegativitas (positif dan negatif) yang sangat kecil bahkan hampir tidak ada. Ikatan kovalen umumnya terdapat dalam sebagian besar ikatan dalam senyawa organik. 6. Gambarkan struktur senyawa 2 metil pentana dengan benar berdasarkan cara penentuan struktur senyawa organik. Jawab:
7. Tentukan nama struktur senyawa di bawah ini berdasarkan tahapan pemberian nama senyawa organik Cl
H3C-CH-CH-CH2-CH3
Br Jawab: 2-Bromo-3-Kloro-Pentana
8. Gambarkan struktur senyawa 1,3-dimetil sikloheksana dengan benar berdasarkan cara penentuan struktur senyawa organik. Jawab:
CH3
CH3
9. Tuliskan 5 sifat alkana yang anda ketahui. Jawab: 1) Merupakan senyawa nonpolar, sehingga tidak larut dalam air. 2) Pada suhu kamar, alkana dengan atom C1-C4 berfase gas, C5-C17 berfase cair dan > C18 berfase padat. 3) Bila rantai C semakin panjang viskositas ( kekentalan) semakin tinggi,titik didih semakin tinggi.
4) Untuk alkana yang berisomer , dengan atom C sama banyak, semakin banyak jumlah cabang semakin rendah titik didihnya. 5) Alkana dapat bereaksi dengan oksigen melalui reaksi pembakaran. 10. Tuliskan 5 kegunaan senyawa alkana yang anda ketahui. Jawab: 1. Metana; berguna sebagai bahan bakar untuk memasak, dan bahan baku pembuatanzat kimia seperti H2 dan NH3. 2. Etana; berguna sebagai bahan bakar untuk memasak dan sebagai refrigerant dalam sistem pendinginan dua tahap untuk suhu rendah. 3. Propana; merupakan komponen utama gas elpiji untuk memasak dan bahan baku senyawa organik. 4. Butana; berguna sebagai bahan bakar kendaraan dan bahan baku karet sintesis. 5. Oktana; merupakan komponen utama bahan bakar kendaraan bermotor, yaitu bensin. 11. Salah satu Reaksi senyawa alkana yang anda diketahui radial bebas. Tuliskan semua kemungkinan reaksi yang terjadi pada reaksi C2H6 +Cl2 C₂H₆ + Cl₂ → C₂H₅Cl + HCl etana + klorin → etil klorida + asam klorida
H
H
H H
|
|
|
|
H - C - C - H + Cl - Cl → H - C - C - Cl + H - Cl |
|
|
|
H
H
H H
Reaksi dari senyawa hidrokarbon alkana dengan unsur-unsur halogen disebut reaksi halogenasi. Reaksi ini akan menghasilkan senyawa alkil halida. Atom hidrogen dari alkana akan disubstitusi oleh halogen sehingga reaksi ini dapat disebut sebagai reaksi substitusi. 12. Mengapa alkena bercabang memiliki titik didih yang lebih rendah dibandingkan dengan alkena rangkai lurus dengan jumlah atom C yang sama. Jawab : Dengan adanya percabangan pada struktur alkana, maka bentuk molekul alkena cenderung menyerupai bentuk bola/bulat. Akibatnya luas permukaan bidang singgung antar molekul menjadi berkurang atau interaksi yang terjadi antar molekul menjadi berkurang sehingga gaya tarik antar molekulnya rendah. Dan untuk mengalahkan gaya tersebut hanya diperlukan energi yang dapat dicapai pada suhu rendah. 13. Tuliskan 5 senyawa alkena dan kegunaannya dalam kehidupan Jawab :
Etena digunakan sebagai bahan baku pembuatan polietena
Etena juga digunakan sebagai bahan baku pembuatan senyawa organik intermediet seperti kloroetena dan stirena
Propena digunakan sebagai bahan baku pembuatan polipropena. Polipropena merupakan polimer untuk membuat serat sintetis, materi pengepakan, dan peralatan masak.
Butadiena digunakan sebagai bahan baku pembuatan polibutadiena (karet sintetis)
Alkena suku rendah (etena, propena, dan butena) digunakan sebagai bahan baku pembuatan alkohol.
14. Karbit dapat digunakan untuk mengelas a. Mengapa karbit dapat digunakan untuk mengelas jawab: 1. Peralatan relatif murah dan memerlukan pemeliharaan minimal/sedikit, 2. Cara penggunaannya sangat mudah, tidak memerlukan teknik-teknik pengelasanyang tinggi
3. sehingga mudah untuk dipelajari, 4. Mudah dibawa dan dapat digunakan di lapangan maupun di pabrik atau dibengkelbengkel 5. karena peralatannya kecil dan sederhana, 6. Dengan teknik pengelasan yang tepat hampir semua jenis logam dapat dilas danalat ini 7. dapat digunakan untuk pemotongan maupun penyambungan
b. Tuliskan reaksi karbit dengan air jawab: CaC2 + 2 H2O → C2H2 + Ca(OH)2 15. Jelaskan Perbedaan alcohol primer dan alcohol sekunder dan berikan contohnya 1) Alkohol primer adalah alkohol dengan gugus –OH terikat pada atom C primer. Contoh :
CH3–CH2–CH2–CH2–OH butanol
CH3–CH2–CH2–OH propanol
2) Alkohol sekunder adalah alkohol dengan gugus –OH terikat pada atom C sekunder. Contoh : Gugus –OH selalu diikat oleh CH. Oleh karena itu, secara umum rumus struktur dari alkohol sekunder adalah seperti berikut.
16. Tuliskan 5 senyawa alcohol dan kegunaannya dalam kehidupan. Jawab :
1. Sebagai komponen aktif dalam minuman bir, anggur dan wiski 2. Etanol dengan kadar 70% digunakan sebagai zat antiseptik 3. Sebagai bahan baku pembuatan senyawa aldehida dan keton 4. Metanol digunakan sebagai campuran bahan bakar spirtus 5. Sebagai pelarut polar 17.
Berdasarkan rumus molekul dan rumus strukturnya apa persamaan dan perbedaan
alcohol dan eter.
Jawab : Alkohol dan eter disebut pasangan isomer fungsi , karena kedua senyawa tersebut memiliki rumus molekul sama tetapi gugus fungsinya berbeda . Karena gugus fungsi alkohol dan eter berbeda maka sifat-sifat alkohol dan eter berbeda sekali . Perbedaan alcohol dengan eter sebagai berikut :
Zat cair jernih ,mudah larut dalam air . Zat cair jernih , sukar larut dalam air.
Titik didih alcohol lebih tinggi ( bila Mr senyawanya sama ) Titik didih eter lebih rendah ( bila Mr senyawanya sama )
Akohol bereaksi dengan logam aktif ( Na atau K ) membebaskan gas H2 Eter tidak bereaksi dengan logam aktif ( Na atau K )
Akohol bereaksi dengan PCl5 membebaskan uap HCl Eter bereaksi dengan PCl5 tetapi tidak membebaskan uap HCl.
18. Tuliskan 3 kegunaan senyawa eter dalam kehidupan Jawab : Kegunaan senyawa eter dalam kehidupan yaitu sebagai berikut :
Eter digunakan sebagai pelarut senyawa karbon,
Dietil eter digunakan sebagai obat bius pada operasi,
Sebagai anti septik untuk mencegah infeksi,
Metil ters-butil eter (MTBE) digunaka unutuk menaikkan angka oktan bensin.
19.
Berdasarkan rumus struktur dan rumus molekulnya apa persamaan dan perbedaan
aldehid dan keton Jawab : Perbedaan Gugu karbonil aldehid terikat pada hidrogen dari satu ujung, tetapi dalam keton, gugus karbonil terikat pada atom karbon dari kedua belah pihak.aldehid. Oleh karena itu, gugus fungsional keton selalu terlihat di tengah molekul, dan gugus aldehid selalu di ujung. Dalam nomenklatur tersebut, aldehid memiliki akhiran -al dan keton akhiran adalah -on.keton Dalam molekul dimana aldehid adalah gugus fungsional, karbon karbonil diberikan nomor satu pada nomenklatur. Dalam keton, rantai diberi nomor dengan cara memberikan nomor serendah mungkin pada karbon karbonil (tidak akan mendapatkan nomor satu di setiap kesempatan).Aldehid dapat dengan mudah teroksidasi dibandingkan dengan keton. Persamaan Aldehid dan keton merupakan kelompok senyawa organic yang mengandung gugus karbonil. Aldehid dikenal dengan rumus RCHO, sedangkan suatu keton mempunyai dua gugus alkil yang terikat pada karbon karbonil dengan rumus RCOR.
20. Tuliskan kegunaan senyawa aldehida dalam kehidupan Jawab :
Kegunaan senyawa aldehida dalam kehidupan sehari-hari yaitu sebagai berikut :
Formaldehida (metanal) digunakan sebagai pembunuh kuman dan mengawetkan.
Formaldehida digunakan untuk membuat plastik termoset (plastic tahan panas).
Paraldehida digunakan sebagai akselerator vulkanisasi karet
21. Tuliskan kegunaan senyawa keton dalam kehidupan Jawab :
Kegunaan senyawa keton dalam kehidupan sehari-hari yaitu sebagai berikut :
Pelarut senyawa karbon, misalnya sebagai pembersih cat kuku.
Bahan baku pembuatan zat organic lain seperti chlaroform yang digunakan sebagai obat bius.
Selain aseton beberapa senyawa keton banyak yang berbau harum sehingga digunakan sebagai campuran parfum dan kosmetika lainnya.
22. Berdasarkan rumus molekul dan rumus strukturnya apa persamaan dan perbedaan karboksilat dan ester Jawab : Perbedaan 1. Asam karboksilat memiliki titik didih yang lebih tinggi dibandingkan ester karena terdapat ikatan hidrogen. 2. Beberapa asam karboksilat tidak berbau atau memiliki bau yang sedikit menyengat sedangkan ester memiliki aroma yang harum sehingga digunakan sebagai essens pada makanan. 3. Asam karboksilat bereaksi dengan basa kuat menghasilkan garam dan air. {R-COOH + NaOH ------> R-COO-Na + H2O} Ester bereaksi dengan basa kuat menghasilkan garam dan alkohol. {R-COO-R ' + NaOH -----> R-COO-Na + R'-OH}. 4. Asam karboksilat bereaksi dengan alkohol membentuk ester dan air disebut reaksi esterifikasi sedangkan reaksi ester dengan air menghasilkan asam karboksilat dan alkohol disebut reaksi hidrolisis. Persamaan 1. Asam karboksilat dan ester termasuk senyawa turunan alkana 2. Keduanya merupakan isomer fungsi karena memiliki rumus umum yang sama yaitu CnH2nO2
3. Ester atau alkil alkanoat merupakan senyawa turunan dari asam karboksilat. Ester dapat diperoleh dari reaksi antara asam karboksilat dan alkohol yang disebut esterifikasi. Atom H pada gugus -COOH digantikan gugus alkil R- dari alkohol. Persamaan reaksinya yaitu : R-OH + R-COOH ---------> R-COOR + H2O 23. Tuliskan kegunaan senyawa asam karboksilat dalam kehidupan! Jawab : asam asetat dalam pembuatan cuka Garam natrium sebagai pengawet Asam asetat dalam pembuatan karet Asam organik sebagai bahan pewarna
24. Tuliskan kegunaan senyawa ester dalam kehidupan! Jawab : Sebagai pengharum Bahan pembuatan lilin Obat penghilang rasa sakit Pembuatan cat dan lem
25. Apa yang dimaksud dengan A. Isomer rantai B. Isomer fungsional C. Isomer geometri D. Isomer optik Jawab :
Isomer rantai adalah jika senyawa-senyawa organik mempuyai rumus molekul yang sama tetapi urutan atom-atom penyusun senyawa tersebut berbeda karena terbentuknyacabang-cabang pada rantai lurus atau bergesernya ikatan rangkap atau bergesernya gugus fungsi dalam sebuah molekul.
Isomer fungsional adalah senyawa yang mempunyai rumus molekul sama tetapi mempunyai rumus struktur berbeda karena perbedaan gugus fungsional yang terikat pada senyawa tersebut.
Isomer geometri adalah senyawa-senyawa yang mempunyai rumus molekul sama namun memiliki struktur ruang yang berbeda.
Isomer optik adalah salah satu isomer konfigurasi yang mampu memutar bidang cahaya terpolarisasi searah atau berlawanan arah jarum jam.
26. Tuliskan semua kemungkinan isomer pentana (C5H12) ! Jawab : A. Isomer rantai lurus CH3-CH2-CH2-CH2-CH3 = n-pentana B. CH3-CH-CH2-CH3 = 2-metil-butana | CH3 C.
CH3 |
CH3-C-CH3 = 2,2-dimetil-propana | CH3 27. Mengapa senyawa kedua senyawa dibawah ini berisomer! CH3-CH=CH-CH3 (2-butena)
CH2=C-CH3 (2-metil propena) | CH3
Jawab : karena kedua senyawa ini memiliki rumus molekul yang sama yaitu C4H8 28. Tuliskan semua kemungkinan isomer dari pentanol Jawab :
A. n-pentanol = CH3-CH2-CH2-CH2-CH2-OH B. 2-pentanol= CH3-CH2-CH2-CH-CH3 | OH C. 3-pentanol= CH3-CH2-CH-CH2-CH3 | OH D. 2-metil-1-butanol = CH3-CH2-CH-CH2-OH | CH3 E. 3-metil-1-butanol = CH3-CH-CH2-CH2-OH | CH3 F. 2,2-dimetil-propanol
=
OH |
CH3-CH2-C-CH3 | CH3 G. 1,2-dimetil-propanol
= CH3-CH-CH-CH3 | | CH3 OH
29. Tuliskan struktur senyawa dengan nama 5,6,6,7-heksan-metil-3-oktena! Jawab : C6H14
CH3
|
|
CH3-CH2-CH2-CH2-CH=CH-CH2-CH3 |
|
|
C6H14 C6H14 C6H14 30. Apa perbedaan rumus struktur senyawa cis dan trans pada senyawa alkena. Jawab:
Molekul di mana dua atom yang samaberada di sisi yang sama dari ikatan rangkap dikenal sebagai isomer cis. Molekul dengan dua atom yang sama di sisi berlawanan dari ikatan rangkap dikenal sebagai isomer Trans. Isomer Cis bersifat polar, dan isomer Trans relatif non polar. Isomer cis memiliki titik didih yang lebih tinggi dibandingkan dengan isomer trans. isomer Trans memilikititiklebur yang lebihtinggi; Sebaliknya, molekul cis memiliki titik lebur yang lebih rendah. molekul Trans dikemas baik daripada molekul cis. Struktursenyawa cis dan trans
31. Apa yang dimaksud dengan atom C asimetris dan tuliskan contohnya. Jawab: Atom C asimetris adalah atom C yang keempat valensinya mengikat atom atau gugus atom yang berbeda. Sifat optis aktif ditunjukkan oleh senyawa yang mempunyai atom C asimetris. Contoh atom C asimetris adalah pada senyawa 1,2 propandiol yang mempunyai rumus struktur CH3-C*HOH-CH2OH yang mana atom C* mengikat: Satu CH3, Satu H, Satu OH, Satu CH2OH. 32. Apa perbedaan isomer levodan isomer dektro serta berikan contohnya. A. Isomer dekstro (d), yaitu senyawa yang arah pemutarannya ke kanan (sesuai dengan arah jarum jam), dan sudutnya berharga positif. B. Isomer levo (l), yaitu senyawa yang arah pemutarannya ke kiri (berlawanan dengan arah jarum jam), dan sudutnya berharga negatif. Dengan demikian ada dua macam senyawa 2- butanol, yaitu a. d-2-butanol, dengan sudut pemutaran = + 13,52 b. l-2-butanol, dengan sudut pemutaran = - 13,52 33. Tuliskan gugus pengarah orto dan para serta pengarah meta pada disubstitusi senyawa aromatis. a. Gugus pengarah orto dan para Yang dimaksud gugus pengarah orto-para adalah gugus substituen yang menyebabkan arah utama serangan elektrofil pada posisiortodan/ atau para terhadapkedudukangugussubstituentersebut. Guguspadacincinakanmengarahkansubstituen yang barumasukpadaposisiorto, para atau meta sesuaidengangugusmulanya. Gugusmulatersebut yang disebutsebagaipenentuorientasi. Gugus yang merupakan activator kuatadalahguguspengarahorto, para
(adisielektrofilikmengambiltempatpadaposisiortodan para bergantungpada activator).
Orientasiiniterutamadisebabkanolehkemampuansubstituenpengaktifkuatuntukmele paskanelektron (gugus amino dangugushidoksilmerupakangugus activator yang baik). Guguspengarahorto, para padaumumnyamemasukelektronkecincindandengandemikianmerupakanpengaktifc incin. Pada halogen (F, Cl, Br, dan I) keduaefek yang berlawananinimengakibatkanpengecualianpadaaturantersebut. Karenabersifatsebagaipenarikelektronkuat, halogen merupakanpendeaktifcincin, namunkarenaadanyapasanganelektronbebas, makahalogen ialahpengarahorto, para. b. Guguspengarah meta Guguspengarah meta adalahgugussubstituen yang menyebabkanarahutamaseranganelektrofilpadaposisi meta terhadapkedudukangugussubstituentersebut. Dalamsemuaguguspengarah meta, atom berhubungandengancincinmembawamuatanpositifpenuhatauparsialdandengandem ikianakanmenarikelektrondaricincin. Semuapengarah meta dengandemikianjugamerupakanguguspendeaktifcincin. Suatupengarah meta mempunyai atom bermuatanpositifatausebagianpositif yang terikatpadacincinbenzena. Dalamreaksinitrobenzena, gugusnitronyatidakmenambahkesetabilanintermedietnya. Malahanintermedietsubstitusiorto, atau para dankeadaantransisinyakurangstabil (karena energy yang tinggi), karenasebuahstrukturresonansimengandungmuatanpositifpada atom berdekatan. Olehkarenaitu, substitusiterjadilebihbanyakpadatempat meta, sebabkeadaantransisidanintermediatnyapadatempat yang berdekatanmengandungmuatanpositif. 34. Tuliskanstruktur A. Orto dikloro benzene
B. Para etilfenol
Nuklida
Jumlah proton (z)
Hg201 201 79Au 202 80Hg 202* 80Hg
80 79 80 80
80
Jumlah Neutron (N) 121 120 120 120
JumlahNukleon (A) 201 201 202 202
2. Berdasarkan kesamaan jumlah proton ,neutron,dan nucleon,nuklida diatas dapat dikelompokkan menjadi : 1.isotop: 80Hg201dengan80Hg202 2.isobar: 80Hg201dengan79Au201 3. isoton:79Au201dengan 80Hg202 4. isomerinti :80Hg202dengan 80Hg202* 3.Lengkapi sifat dan contoh klasifikasi nuklida berikut : No 1 2 3
4 5
JenisNuklida Nuklida Stabil Radionuklida alam primer
Sifat -N/Z>1 -radioaktif -waktu paruhnya panjang -terbentuk secara alami Radionuklida alam -waktu paruhnya pendek sekunder -tidak dapat ditemukan dialam ,tetapi dapat dibentuk secara kontinu Radio nuklida alam -dipengaruhi oleh interaksi sinar terinduksi kosmik diatmosfer Radionuklidabuatan -terbentuk tidak secara alamiah tetapi hasil sintesis -dapat memancarkan jenis radiasi alpa,beta,gamma,dan neutron.
4. Ada empat factor yang menentukan kestabilan inti yaitu: 1.perbandingan neutron terhadap proton 2.mempunyainomor atom rendah ,nilai n/p mendekati 1
Contoh 4 2He 238 92u Th234
90
C14 ,7N14
6
Bidang kedokteran :24Na untuk mendeteksi adanya gangguan peredaran darah Bidang pertanian37P dan14C Untuk mengetahui tempat pemupukan yang tepat
3. meningkatnya hormone atom,perbandingan neutron terhadap proton dan inti stabil menjadi lebih besardari 1 4. penyimpanan pada nomor-nomor atom yang lebihtinggi 5.Lengkapi table berikut untuk 3 macam inti yang tidak stabil ,cara mencapai stabil dan reaksi yang terjadi
No 1
Intitakstabil Diatas pita kestabilan (Z<83)
2
Z>83
3
Dibawah pita kestabilan
Cara mencapaistabil Nuklida ini mengubah neutron menjadi proton danpartikel beta Melepas sejumlah partikel alfa (inti atom He) Memancarkan positron ataupenangkapan electron
Reaksi 137 53I
P1
1
P136+0n1
53
n1+1e0
0
Be7+-1e0
4
Li7
3
6. Lengkapi tabel berikut untuk Jenis Peluruhan Zat Radioakif
No Jenis Peluruhan 1 Peluruhan alfa (α) 2
Peluruhan Beta - Pemancaran negatron ( ) - Pemancaran posiotron (
Persamaan Umum → z-2
+2
→ z+1 Z + 1 → z-1 Y + →-
Contoh 210 →84Pb206 + 2He4 84Po
+
K40→20Ca40 + -1β0 40 40 0 20Sc →20Ca + +1β 44 0 44 22Ti + -1e → 21Sc 19
→ Z-1
)
3 4 5 6
7.
- Penangkapan erlectron (Electron capture, EC). Peluruhan gamma (Transisi isomerik) Pembelahan spontan Pemancaran Neutron Pemancaran neutron terlambat
→ 2AX + -
C060m→27Co60 + y’
22
Cf254→42Mo108+56Ba142+40n1 87 87 1 36Kr →36Kr + 0n 87 87 0 87 35Br →36Kr + -1β →36Kr + 1 0n 98
Transmutasi Inti adalah penembakan nuklida suatu atom dengan proyektil atomik sehingga terbentuk nuklida baru yang stabil. Reaksi umum M (a,b) M’ M : Inti yang ditembak. a : proyektil atom yang menembak.
b. Partikel yang dibebaskan pada reaksi nuklir. M’ : inti hasil penembakan Contoh reaksi transmutasi inti :7N14 (α, p) 8O17 Ada dua macam proyektil yaitu : 1) Partikel bermuatan contoh 1H1, 1H2, 2He4, atau 6C12. 2) Partikel bermuatan contoh neutron 8.
Selesai massa suatu inti terhadap massa nukleon pembentuknya disebut Defek massa Selisih massa ini bila dikonversikan ke energi sesuai dengan persamaan Einstein adalah merupakan harga energi pengikat inti.
9.
Jika harga energi pengikat inti ini dibagi dengan jumlah proton + neutron (nukleon) disebut Energi pengikat inti per nukleon.
10. Hitung energi pengikat inti dan energi pengikat inti pernukleon (MeV) dari 2He4 dan 26Fe56 jika massa satu proton = 1,0078 sma, massa satu neutron = 1,0087 sma, massa atom He = 4,0026 sma dan massa Fe = 55,9349 sma. Untuk menyelesaikan soal di atas dapat juga digunakan rumus : Energi ikat inti = (Z x Mp) + ((A-Z) x Mn) – MA x 931 MeV Dimana : Z = nomor atom (jumlah proton), Mp = massa proton, A = nomor massa (jumlah proton + jumlah neutron), Mn = massa neutron, MA = Massa Atom Jadi : a) 2He4 Energi pengikat inti 2He4 = (Z x Mp) + ((A-Z) x Mn) – MA x 931 MeV = ((2 x 1,0078) + ((4 – 2 ) x 1,00866) – 4,0026) x 931 MeV)) = (2,0156) = (2 x 1,00866) – 4,0026) x 931 MeV = (2,0156 + 2,01732 – 4,0026) x 931 MeV = 0,03128 X 931 MeV = 29,12168 MeV 56 b) 26Fe Energi pengikat inti 26Fe56 = (Z x Mp) + ((A-Z) x Mn) – MA x 931 MeV = (26,1893 + 30,2598 – 55,9349) x 931 MeV = 0,5142 x 931 MeV = 478,72 MeV 11. Peluruhan radioaktif mengikuti laju reaksi orde ke satu. Laju peluruh berbanding lurus dengan junlah radionuklida, yang dinyatakan dengan : -dN/dt = N, dimana N = ........ t =...... perbandingan diatas dapat diubah menjadi suatu persamaan dengan memasukkan tetapan perbandingan
, menjadi : -dN/dt = N. Penyelesaian persamaan peluruhan
adalah? Hubungan anatara tetapan peluruhan dan waktu paruh (t1/2) adalah : (t1/2) ?
Penyelesaian : N = Jumlah radioanuklida t = Waktu Persamaan peluruhan dari -dN/dt = N : -dN/dt = N
laju perubahan = keaktifan ( A = -dN/dt atau A = N )
-dN/N = - t
/N = -
In N
No = - t
In N/No = - t atau In A/Ao = - t N/No =
12.
atau N = No
Ditemukan tulang suatu binatang purba yang mempunyai keaktifan C 14 3,75 dpm/g. Perkirakan berapa yahun yang lalu binatang itu hidup (t1/2 C14 = 5668 tahun). Keaktifan C14 mula-mula = 15,3 dpm/g. Penyelesaian : Dik : t1/2 C14 = 5668 tahun N
= 2,75 dpm/g
NO
= 15,3 dpm/g
Dit : t = ....? Jawab : t1/2 = 0,693/ = 0,693/t1/2 = 0,693/56668
In(N/No) = - t 2,303 log N/No = - t 2,303 log 2,75/15,3 = -(0,693/56668) . t 2,303 x (-0,745) = -1,22 x 10-4tahun . t t = 14063 tahun
13.
Suatu isotop radioaktif mempunyai waktu paruh 5 hari. Berapa persen radio isotop tersebut yang sisa bila tersimpan 25 hari. Penyelesaiian : Sisa = (1/2)n x 100% n = Waktu paruh 30 hari/5hari = 6 Sisa = (1/2)6 x 100% = (1/64) x 100% = 1,56%
14.
Lengkapi perbedaan antara reaksi fisi dan reaksi fusi pada tabel berikut
Jenis Reaksi Fisi
Pengertian Pembelahan inti berat menjadi dua inti dengan nomor massa yang lebih kecil
Contoh -
U235 + 0n1
92
Mo103 + 50Sn131 + 2 1 0n -
Energi yang dibebaskan
235
U
92
500 ton
1
+ 0n
Ba141 + 50Kr92+ 3 1 0n Fusi
Penggabugan dua - 4 1H1 2He4 + 2 inti ringan menjadi yang lebih berat, inti e0 + energi menjadi lebih stabil. 1
20.000 ton
-
H1 + 1H3
1
He4
2
+ 1e0 + energi
15. Lengkapi konversi satuan berikut 10 Ci
= 37.10 10 desintegrasi/s = 37.10 10 Bq
1000 rad = 1 Gy 16. Mana yang lebih merusak radiasi 100 rad sinar alfa atau 100 rad sinar beta. Berikan penjelasannya Jawab : 100 rad sinar alfa lebih merusak daripada 100 rad sinar beta. Karena partikel sinar alfa memiliki beban yang lebih besar daripada sinar beta. Oleh karena itu rad biasanya dikalikan drngan faktor yang mengukur kerusakan biologi relatif yang disebabkan oleh radiasi. Faktor ini disebut REB ( Relative Biologycal Effetiveness of Radiation). Hasil kali rad dan REB menghasilkan dosis yang disebut rem(Rontgen Equivalen for Man). 17. Efek radiasi tergantung pada 1. 2. 3. 4.
Energi radiation Kemampuan daya tembus radiasi Kemampuan pengionan dari radiasi Sifat kimia dari sumber radiasi
18. Lengkapi tabel berikut untuk penggunaan radioisotop:
No
Bidang
1
Kimia
Radioisotop yang digunakan Teknik peruntun
2
Kedokteran
24
24
131
Na Na Cl I
Fosfor 59Fe
3
Pertanian
Radiasi gamma fosfor
Digunakan sebagai Untuk mempelajari mekanisme berbagai reaksi kimia. Untuk mengikuti peredaran darah dalam tubuh. Untuk mengetahui penyumbatan dalam saluran darah. Untuk mempelajari kelainan pada kelenjar tiroid. Untuk menentukan tempat tumor otak. Untuk mengukur laju pembentukan sel darah merah dalam tubuh dan menentukan apakah besi dalam makanan dapat digunakan dengan baik dalam tubuh. Untuk memperoleh bibit unggul. Untuk pemakaian pupuk oleh tanaman.
4
Industri
Penggunaan radioisotop Penyiraman radiasi
Untuk mendeteksi kebocoran pipa yang ditanam dalam tanah atau beton. Untuk menentukan keausan dan keroposan yang terjadi pada bagian pengelasan logam.
Halaman 2 Tugas Rutin 01 : Radio Kimia Soal Pilihan Berganda 1. Nuklida
U238 memiliki partikel dibawah ini kecuali...
92
a. 92 proton
b. 92 elektron c. 92 neutron d. 146 neutron e. 238 nukleon
Jawab: C. 92 Neutron 2. Untuk reaksi : 48Cd104 47Ag104+ X, X adalah... a. proton b. elektron c. positron d. neutron e. gamma Jawab: C. Positron 3. Kedua nulida 14Si30, 15P31 disebut... ba. isotop b. isobar c. isoton d. isomer e. isoelektron Jawab: C. Isoton 4. Kedua isotop 54Xe130 , 56Ba130 disebut... a. isotop b. isobar c. isoton d. isomer e. isoelektron Jawab: B. Isobar 5. Unsur dibawah ini yang intinya paling stabil adalah... a. 6C12 b. 8O16 c. 14Si28 d. 26Fe56 e. 29U238 12 Jawab: A. 6C 6. Inti dengan susunan dibawah ini yang lebih stabil adalah... a. 90 proton dan 147 neutron b. 90 proton dan 144 neutron c. 91 proton dan 147 neutron d. 91 proton dan 144 neutron Jawab: A. 90 proton dan 147 neutron 7. Untuk proses 13Al27 (α,x) 15P30 , x adalah... a. sinar alfa b. sinar gamma c. neutron Jawab: C. Neutron 8. Untuk proses 7N15 (p,x) 6C12, x adalah : a. Positron b. Neutron c. Sinar beta d. Sinar alfa e. Deuteron
d. proton
Jawab: N15 +
7
+ 6C12 karena x adalah sinar alfa yang bermuatan +
9. Untuk proses 13Al27(x,α) 12Mg25 , X adalah : a. Neutron
e. positron
b. c. d. e.
Deuteron Positron Proton Electron
Jawab: Al27 +
+ 12Mg25 , karena x merupakan deutron dikarenakan muatannya
13
10. Suatu nuklida radioaktif mempunyai waktu paruh 50 menit. Sebanyak 640 atom cuplikan radioaktif tersebut meluruh selama 100 menit. Berapa cuplikan yang masih tertinggal? a. 320 atom b. 160 atom c. 120 atom d. 60 atom e. 30 atom Jawab: Dik : No= 640 atom n = t/t1/2 = 100/50= 2 Dit : Nt…? Nt
= No (1/2) n
= 640 (1/2)2 = 160 atom Jadi cuplikan yang masih tertinggal sebanyak 160 atom. 11. Intensitas radiasi yang dipancarkan oleh unsure radioaktif berubah menjadi seperdelapan intensitas awal setelah 48 hari. Waktu paruh unsure radioaktif adalah a. 6 hari b. 8 hari c. 12 hari d. 24 hari e. 16 hari Jawab: Dik : Nt=1/8 No t= 48 hari Dit : t1/2
=…?
Nt/No
= (1/2)t/t1/2
(1/8) No/No
= (1/2)
(1/2)3
= (1/2)48/T1/2
3
= 48/ t1/2
t½
= 16
jadi waktu paruh unsure radioaktif adalah 16 hari. 12. Reaksi manakah yang merupakan reaksi fisi 252 106 142 1 a. 98 Cf 42 Mo 56 Ba 4 0 n 234 4 b. 238 92 U 94Th 2 He 239 239 0 c. 93 Np 94 Pu 1 e d. 147 N 24He178 O 11H 87 86 1 e. 36 Kr 36 Kr 0 n Jawab: a.
252 98
142 1 Cf 106 42 Mo 56 Ba 4 0 n
13. Nuklida yang dipakai sebagai perunut untuk mempelajari kelenjar tiroid adalah : a. C14 b. Fe59 c. Sr90 d. I131 e. U235 Jawab: d. I131. Karena I131 adalah isotop yang selalu memancarkan sinar radiasi yang dapat merunut kelenjar tiroid. 14. Salah satu unsur transuranium adalah : a. Al b. As c. Ar d. Ac e. Am Jawab: e. Am. Amerisium adalah unsur kimia sintetik dalam sistem periodik unsur yang memiliki lambang Am dan nomor atom 95 dan merupakan salah satu unsur dari transurium.
15. Waktu paruh C14 adalah 5730 tahun dan dalam materi hidup laju peluruhannya 15 disintegrasi permenit pergram. Benda kayu zaman purba mempunyai laju peluruhan 1,875 disintegrasi permenit pergram. Umur benda purba tersebut adalah : Jawab: c. 17.160 tahun Dik: No=15 Nt=1,875
T1
2=
5730
Dit: t=? Nt 1 No 2
t
5730
1,875 1 15 2 1 1 8 2 3
t
1 1 2 2
t
5730
t
5730
5730
t
5730
3
t 17.160 tahun
Essay 1. Hitunglah energi ikat pernukleon untuk 1H2 dan 1H3 bila diketahui massa atomnya masingmasing 2,012421 sma dan 3,01605 sma.
Penyelesaian : Dik: Untuk 1H2 Z = 1 , A =2 MA= 2,01421 Untuk 1H3 Z =1,A=3 MA= 3,01605 MP =1,00728 Mn=1,00866
Untuk 1H2 Energi pengikat inti = [(Z X MP) + ((A-Z) X Mn) – MA] X 931 MeV = [(1 X 1,00728) + ((2-1) X 1,00866) – 2,01421] X 931 MeV = [1,00728 + 1,00866 – 2,01421] X 931 MeV = 0,00173 X 931 MeV = 1,61063 MeV
Energi pengikat pernuklean = =1,61063 MeV : 2 = 0,805315 MeV Untuk 1H3 Energi pengikat inti = [(Z X MP) + ((A-Z) X Mn) – MA] X 931 MeV = [(1 X 1,00728) + ((3-1) X 1,00866) – 3,01605] X 931 MeV = [1,00728 +(2 X 1,00866) – 2,01421] X 931 MeV = 0,00855 X 931 MeV = 7,96005 MeV Energi pengikat pernukleon = energi pengikat inti : jumlah nukleon =7,96005 MeV : 3 = 2,65335 MeV 2. Defek massa untuk inti 3Li6 adalah -0,03434 g/mol . Hitunglah massa atom 3Li6 Penyelesaian : Δm -0,03434 - 0,03434 MA MA
= [(Z X MP) + ((A-Z) X Mn) – MA ] = [(3 X 1,00728) + ((6-3) X 1,00866) – MA] = (3,02184 + 1,00866 – MA) = 6,04782 + 0,03434 = 6,08216 sma
3. Sebuah batuan mengandung 0,346 mg pb-206 untuk setiap mg U-238. Waktu paruh uranium menjadi timbale adalah 4,5x109 tahun. Berapa usia batuan tersebut Penyelesaian : Dik Hubungan peluruhan dengan peruh waktu adalah jika t=t1/2 maka; N= ½ No
In ½ No/No = λt ½ λt ½ = In 2 λt ½ = 0,693 t ½ = 0.963/λ dimana t1/2 = 4.5x 109 λ = 0.963/4.5x109 λ= 0.00214 maka; In (N/No) = -λt 2,303 log N/No = -λt 2,303 log 0,346 = -0.00214 t -1,06150/-0.00214 = t t = 496 tahun 4. Suatu cuplikan radio aktif sebanyak 1,0 gram. Cuplikan merupakan pemancar sinar alfa dan diukur keaktifannnya pada keadaan awal dan setelah 7 hari. Hasil pembacaan yang kedua adalah 27,9 % dari keadaan awal. Hitung waktu paruhnya dalam hari. Penyelesaian : Dik : No = 100% Nt = 27,9% t = 7 hari mo = 1 gram Dit : T1/2 = ....? Jwb: Nt/No = e^-∧t 2,303 log Nt/No = -∧t 2,303 log 0,279 = -∧x7 2,303 x (-0,554) = -7∧ ∧ = 0,1824 T1/2 = 0,693/∧ = 0,93/0,1284 = 5,4 hari 5. Tuliskan persamaan reaksi peluruhan di bawah ini : a. Peluruhan alfa dari 95Am241 b. Peluruhan beta dari 13Al28 c. Peluruhan positron dari 6C11
d. Penangkapan elektron dari 16S31 Penyelesaian : a. 95 Am 241 93 Am 237 24 28 28 b. :13 Al 14Y aˆ 1 :13 Al 28 12Y 28 aˆ 1 c. 6 C 11 5 B11 e e d. 2S 2e 2 S
BAB 2 : STRUKTUR ATOM Soal-soal latihan. 1. Apakah sumbangan tiap orang ini terhadap stuktur atom! a. Thomson b. Rutherford c. Bohr d. de Broglie 2. Bagaimanaperbedaan model atom Rutherford denganNiels Bohr? 3. Hitunglahpanjanggelombangseberkas proton yang kecepatannya1,3 × 107m s-1, massa proton adalah 1,67 × 10-24 g! 4. Mengapajumlah proton danjumlah electron harussamadalamsuatu atom ?
5. Sebutkanjumlah proton, elektrondan neutron dari
,
!
6. Sebutkanbilangankuantum orbital 2p! 7. Sebutkanberapa set kemungkinankeempatbilangankuantumuntuk a. n = 5; l = 0 b. n = 4; l = 1 8. tentukanahargabilangankuantumelektronterakhiruntuk11Na, 16S, dan28Ni! 9. Tentukankonfigurasi electron dari20Ca , 35Br, 47Ag, 58Ce, 86Rn, dan91Pa! 10. Barapakahjumlahelektron yang dapatdipunyai atom denganbilangankuantum a. N = 2; l =1 b. n = 3; l= 0 c. n = 3; l = 2; m1= -1 11. Tentukansusunanelektronpadakeadaandasardari atom berikut; 8O,11Na, 12Mg, 20Ca, 24Cr 12. Berapakahjumlahelektrontidakberpasanganpada atom dalamkeadaandasarberikut: a. 14Si b. 29Cu
Penyelesaian: 1. Sumbanganterhadapstruktur atom dari : a. Thomson : memeperkenalkanrumusanatentang atom yang menyatakanbahwa atom adalahmerupakansuatu
bola
padatbermuatanpositifdantersebarelektron-
elektronbermuaannegatifsecaraacak. b. Rutherford : menyatakanstruktur atom bersifatelektronetral, yang berarti memilikijumlahmuatanpositifyanagsamadenganjumlahmuatannegatif. c. Bohr : atom Bohr miripdengan atom hidrogen , yang terdidiriatasintidansatu electron.
Model
atom
Bohr
mampumenjelaskangaris
spectrum
emisidanabsorpsidari atom hidrogendenganmuatanenergitertentu (n = 1, 2, 3, …,∞). d. De Broglie
:
mengemukakan
model
atom
mekanikagelombang.
Ditemukanbahwaelektronmenunjukkansifatdifraksisepertihalnyasinar makalintasan
electron
yang
dikemukakan
Bohr
x,
tidakdibenarkan.
Gelombangtidakbergerakmelaluisuatugaris, melaikanmenyebarpadadaerahtertentu. 2. Perbedaan model atom Rutherford dengan model atom Niels Bohr : - Rutherford menyatakanbahwa merupakansuatumassadenganintibermuatanpositif muatannegatif, -
sedangkan Niels Bohr
jadi
electron
yang
dikelilingiolehmuatan-
bergerakbebasmengelilingi
menyatakanbahwainti
atom
atom
yang
proton
tersebut,
berupa
proton
dikelilingiolehelektron-elektronyanagbergerakdalamlintasan-lintasantertentu.
Sehinggaapabilaelektronberpindahdari orbit awalnyake orbit lainnyadalam atom tersebutakantimbulsuatuloncatanenergi.
3. Diketahui : v = 1,3 × 107m s-1 = 1,3 × 109 cm s-1 m = 1,67 × 10-24 g h = 6,6626 × 10-27 erg. detik Ditanya : panjanggelombang( λ)
Penyelesaian : λ =
=
= 3,069 x 10-10cm
=
4. Jumlah
proton
danelektronharussamakarenaakanmenentukankestabilaninti
tersebut,
kalaujumlah
atom proton
lebihbanyakdibandingjumlahelektronmakaakanmembentuk
ion
poitifdanbegitusebaliknyaapabilajumlahelektronlebihbanyakakanmembentuk
ion
negatif.
Jumlah
proton
dan
neutron
maupuntingkatenergidariinti-inti
stabiltidakakanmengalamiperubahanselamatidakadagangguandariluar. 5. Proton = 23 Elektron= 23 Neutron = massa atom – nomor atom = 23-11 = 12
Proton = 39 Elektron = 39 Neutron = massa atom – nomor atom = 39 – 19 = 20
yang
6. Bilangankuantum orbital 2p: Bilangankuantumutama (n) : 2 Bilangankuantumazimut (l) : 1 Bilangankuantummagnetik (m) : -1 Bilangankuantum spin (s) : + 7. Set kemungkinankeempatbilangankuantum a. n= 5 , l= 0 b. n= 4, l= 1 maka 5s maka 4p 8. Hargabilangankuantumelektronterakhiruntuk : a. 11Na = 1s2 2s22p63s1 1 3s 0
↑ n=
3 , l = 0, m = 0, s = +
b. 16S = 1s2 2s2 2p6 3s2 3p4 4 3p ↑↓ ↑ n= c.
↑
-1
0
+1
3, l=1, m= -1, s = -
Ni = 1s2 2s22p63s23p6 4s23d8 8 3d 28
↑↓ ↑↓ ↑↓ ↑ n =
↑
-2
-1
0
+1 +2
3, l = 2, m= 0, s = +
9. Konfigurasielektrondari : 2 2 6 2 6 2 20Ca = 1s 2s 2p 3s 3p 4s 2 2 6 2 6 2 10 5 35Br = 1s 2s 2p 3s 3p 4s 3d 4p 2 2 6 2 6 2 10 6 2 9 47Ag = 1s 2s 2p 3s 3p 4s 3d 4p 5s 4d 2 2 6 2 6 2 10 6 2 10 6 2 2 58Ce = 1s 2s 2p 3s 3p 4s 3d 4p 5s 4d 5p 6s 4f 2 2 6 2 6 2 10 6 2 10 6 2 14 10 6 86Rn = 1s 2s 2p 3s 3p 4s 3d 4p 5s 4d 5p 6s 4f 5d 6p 2 2 6 2 6 2 10 6 2 10 6 2 14 10 6 2 3 91Pa = 1s 2s 2p 3s 3p 4s 3d 4p 5s 4d 5p 6s 4f 5d 6p 7s 5f 10. Jumlaahelektronpada: a. n=2, l=1 → berartielektronterletakpada sehinggajumlahelektronsebanyak 6 buah. b. n=3, l=0 →berartielektronterletakpada
orbital orbital
sehinggajumlahaelektronsebanyak 2 buah. c. n= 3, l=2, m=-1 → berartielektronterletakpada
orbital
2p 3s 3d
denganbilangankuntummagnetik -1. Ada duakemungkinanjumlahelektronyaitu 2 dan 7. 11. Susunanelektronpadakeadaandasardari atom unsurberikut :
a. 8O = 1s2 2s22p4 b. 11 Na = 1s2 2s22p63s1 c. 12Mg = 1s2 2s22p63s2 d. 20Ca = 1s2 2s22p63s23p6 4s2 e. 24Cr = 1s2 2s22p63s23p6 4s23d4 12. Jumlahelektrontidakberpasanganpada atom dalamkeadaandasarberikut: a. 14Si = 1s2 2s22p63s23p2 Orbital 3p ada 3 buah orbital (kotak). Jumlahelektronpada orbital p seharusya 6. Tetapipada3p2 hanyaterisi 2 orbital. Sehinggajumlahelektrontidakberpasangan da 2 b.
buahelektron. 2 2 6 2 6 2 9 29Cu=1s 2s 2p 3s 3p 4s 3d Orboitalpada 3d ada 5 buah orbital ( kotak). Jumlahmaksimumada 10 tetapipada3d9
hanyaterisidengan
9
elektrondanterdapat
1
buahelektrontidakberpasangan.
Tugas Rutin 02: Kesetimbangan Kimia Soal: 1. Write the equilibrium expression (K) for each of the following gas- phase reactions. a. N2(g) + O2(g) ↔ 2NO(g) b. N2O2(g)↔ 2NO2(g) c. SiH4(g)+ 2Cl2(g)↔ SiCl4(g) + 2H2(g) d. 2PBr3(g) + 3Cl2(g) ↔ 2PCl3(g) + 3Br2(g) 2. Write the equilibrium expression (Kp) for each reaction in exercise 1. 3. For the reaction H2(g) + Br(g) ↔ 2HBr(g) 4 Kp = 3,5 x 10 at 1495 K. what is the value of Kpfor the following reactions at 1495 k? a. HBr(g) ↔
2(g)
+ Br2(g)
b. HBr(g) ↔ H2(g)+ Br2(g) c.
H2(g) + Br2(g) ↔HBr(g)
4. For the reaction 2NO (g) + 2H2(g) ↔ N2(g) + 2H2(g) It is determined that, at equilibrium at a particular temperature, the concentrations are as follows: [ NO(g) ] = 8,1 x 10-3 M, [H2(g)] = 4,1 x 10-5 M, [N2(g)] = 5,3 x 10-2 M. and [H2O(g)]= 2,9 x 10-3 M. Calculate the value of K for the reaction at this temperature. 5. At a particular temperature a 2,00-L flask at equilibrium contains 2,80 x 10 -4 mol N2, 2,50 x 10-5 ml O2, and 2,00 x 10-2 mol N2O. calculate K at this temperature for the reaction 2N2(g) + O2(g) ↔ 2N2O(g) If [N2] = 2.00 x 10-4 M, [N2O]= 0,200 M, and [O2]= 0,000245 M, does this represent a system at equilibrium? 6. At 1100 K, Kp = 0,25 for the reaction
2SO2(g) + O2(g) ↔ 2SO3(g) What is the value of K at this temperature? 7. The following equilibrium pressures were oserved at a certain temperature for the reaction N2(g) + 3H2(g)↔ 2NH3(g) PNH3 = 3,1 x 10-2 atm PN2 = 8,5 x 10-1 atm PH2 = 3,1 x 10 -3atm Calculate the value for the equilibrium constant Kp at this temperature. If PN3 = 0,525 atm ,PNH3 = 0,0167 atm, and PH2 = 0,00761 atm, does this reperesent a system at equilibrium? 8. The equilibrium constant is 0,0900 at 250C fror the reaction H2O(g) + Cl2O(g) ↔ 2HOCl(g) For which of the following sets of conditions is the system equilibrium ?for those which are not at equilibrium , in which direction will the system shift? a. A 1.0-L flask contains 1,0 molHOCl, 0,10 mol Cl2O, and 0,10 mol H2O b. A 2,0- L flask contains 0,084 molHOCl, 0,080 mol Cl2O, and 0,98 mol H2O c. A ,0-L flask contains 0,25 molHOCl, 0,0010 mol Cl2O, and 0,56 mol H2O. 9. For the reaction 2H2O(g)↔ 2H2(g) + O2(g) K = 2,4 x 10-3 at a given temperature. At equilibrium it is found that [H 2O(g)] = 1,1 x 10-1 M and [H2(g)] = 1,9 x 10-2 M. what is the concentration of O2(g) under these conditions? 10. The reaction 2NO(g) + Br2(g) ↔2NOBr(g) Has Kp = 109 at 250C. if the equilibrium partial pressure of Br 2 is 0,0159 atm and the equilibrium partial pressure of NOBr is 0,0768 atm, calvulate the partial pressure of NO at equilibrium. 11. At 350C, K = 1,6 x 10-5 for the reaction 2NOCl(g) ↔ 2NO(g) + Cl2(g) Calculate the concentrations of all species at equilibrium for each of the following original mixtures. a. 2,0mol pure NOCl in a 2,0-L flask. b. 1,0 molNOCl and 1.0 mol NO in a 1,0-L flask c. 2,0 molNOCl and 1,0 mol Cl2 in 1,0-L flask 12. Predict the shift in the equilibrium position that will occur for each of the following reactions when the volume of the reaction container is increased. a. N2(g) + 3H2(g) ↔ 2 NH3 (g) b. PCl5(g) ↔ PCl3(g) + Cl2(g) c. H2(g) + F2(g)↔ 2HF(g) d. COCl2(g) ↔ CO(g) + Cl2(g) e. CaCO3(s) ↔CaO(s) + CO2(g) 13. An important reaction in the commercial production of hydrogen is CO(g) + H2O(g) ↔ H2(g) + CO2(g) How will this system at equilibrium shift in each of the five following cases? a. Gaseous carbon dioxide is removed
b. Water vapor is added c. In a rigid reaction container, the pressure is increased by adding helium gas. d. The temperature is increased (the reactin is exothermic). e. The pressure is increased by decresing the volume of the reaction container. 14. The formation of glucose from water water and carbon dioxide is one of the more important chemical reactions in the world. Plants perform this reaction through the process of photosynthesis, creating the base of the food chain: 6H2O(g) + 6CO2(g)↔ C6H12O6(s) +6O2(g) At a particular temperature, the following equilibrium concentrations were found : [H2O(g)] = 7,91 x 10 -2 M, [CO2(g)] = 9,3 x 10-1 M, and [O2(g)] =2,4 x 10-3 M. calculate the value of K for the reaction at this temperature. 15. At a certain temperature, K = 9,1 x 10 -4 for he reaction FeSCN2+(aq) ↔ Fe3+ (aq) + SNC-(g) Calculate the concentrations of Fe3+, SNC-, and FeSCN2+ in a solution that is initially 2,0 M FeSCN2+. 16. Given the following equilibrium constants at 4270C, Na2O(s) ↔2Na(l) + O2(g)
K1 = 2 x 10-25
NaO(g) ↔ Na(l) + O2(/g)
K2 = 2 x 10-5
Na2O2(s) ↔2Na(l) + O2(g) K3 = 5 x 10-29 NaO2(s) ↔Na(l) + O2(g) K4 = 3 x 10-14 Determine the values for the equilibrium constants for the following reactions. a. Na2O(s) + O2(g) ↔ Na2O2(s) b. NaO(g) + NaO2(s) ) ↔ Na2O2(s) ↔ Na(l) c. 2NaO(g) ↔ Na2O2(s) (hint : when reaction equations are added, the equilibrium expressions are multiplied). 17. A sample of N2O4(g) is placed in an empty cylinder at 25 0C. after equilibrium is reached the totl pressure is 1,5 atm and 16% (by moles) of the original N 2O4(g) has dissociate to NO2 (g) a. Calculate the value of Kp for this dissociation reaction at 250C b. If the volume of the cylinder is increased until the total pressure is 1,0 atm ( the temperature of sytem remains constant), calculatethe equilibrium pressure of N2O4(g) and NO2(g) c. what percentage ( by moles) of the original N 2O4(g) is dissociated at the new equilibrium position (total pressure = 1,00atm )? 18. Hitung Kp pada 500 K untuk sistem 2HI(g)) ↔ H2(g) + I2(g) ,jika Kp pada 300 K adalah 2,16 x 10-3. Asumsikan harga ∆H0 tetap. Harga ∆H0 untuk reaksi di atas adalah 12500 kalori. 19. Jika diketahui data pada temperature 298K untuk ∆G 0f NH3 = -3976 kalori mol-1dan ∆H0f NH3 = -11,040 kkal. Mol-1.Hitung harga kp pada suhu 298 K untuk reaksi3H 2(g) + N2(g) ↔ 2NH3(g).
20. Dalam sebuah wadah dengan volume V liter terdapatsuatucampuran gas dalamkesetimbangan. Komposisicampuran gas ini : 2 mol PCL5, 2mol PCl3, dan Cl2. tekanan total dalam 3 atmpadasuhuT.denganmempertahankansuhudantekanantetap, sejumlah gas Cl2dimasukkankedalamwadahsehinggavolumenyamenjadi 2V liter. Semua gas dianggapideal .berapaumlahmol CL2 yang dimasukkan? 21. Tekananuapamoniapadasuhu -500C adalag 0,4034 atm, sementarapadasuhu 00Cadalah 0,42380 atm. Pertanyaan: a. Hitungentalpi molar penguapan (∆Hvap) dari ammonia b. Hitungsuhudidih normal NH3(l)
Pembahasan: 1. a. N2(g) + O2(g) ↔ 2NO2(g)
K= b. N2o4(g) ↔ 2NO2(g)
K= c.SiH4(g)+ 2Cl2(g)↔ SiCl4(g) + 2H2(g)
K= d.2PBr3(g) + 3Cl2(g) ↔ 2PCl3(g) + 3Br2(g) K=
2. solving from number 1 a. N2(g) + O2(g) ↔ 2NO2(g) b K= b.
N2o4(g) ↔ 2NO2(g) K=
c. SiH4(g) + 2Cl2(g) ↔ SiCl4(g) + 2H2(g) K = d. 2PBr3(g) + 3Cl2(g) ↔ 2PCl3(g) + 3Br2(g) K= 3. a. 17,5 x 104 b.3,5 x 104 c. 17,5 x 104
4. K=
=
=
= = 0,113 x 108 = 113 x 105 5. Kp =
=
= =0,4 x 109 = 4x108 6. Kp = Kc x R x T∆n 0,25atm = Kc x 0,082 atm.L/K.Mol x 1100 K 0,25 = Kc x 90,2-1 Kc = 2,77 x 10-2 7. N2(g) + 3H2(g)↔ 2NH3(g) Kp =
Kp =
Kp = Kp = 0,037951 x 106 = 37.951
8. Kp =
=
= 111,6
9. 2H2O(g)↔ 2H2(g) + O2(g)
K=
2,4 x 10-3 =
2,4 x 10-3 = [2,904 x 10-5 ]= [3,61 x 10-4 ]x [O2]
[O2] =
= 0,804x 10-1
10. Kp =
109 =
109 =
[NO]2 =
= 0,0584 atm
11. a. [NOCl] = 2,0 – (2 x 0,016) = 1,97 M= 2,0
[NO] = 0,032 M [Cl2] = 0,016 M b.[NOCl] = 1,0 – (2 x 1,6. 10-5) = 0,999968 M= 0,1 [NO] = 1,0 + (2 x 1,6. 10-5) = 1,0 M [ Cl2] = 1,6 x 10-5 M c.[NOCl] = 2,0 – (2x 4. 10-3) = 1,992 M M= 2,0 [Cl2] = 1 + 4.10-3 = 1 M [ NO] = 0,008M 12. a. If volume of the reaction container is increased so the equilibrium will shift left b.If volume of the reaction container is increased so the equilibrium will shift right c.If volume of the reaction container is increased so the equilibrium will shift left d. If volume of the reaction container is increased so the equilibrium will shift right e.If volume of the reaction container is increased so the equilibrium will shift right
to to to to to
13. a. shift to right b.shift to right c.no shift, helium gaseus is neither a reactan or product (inert gaseus) d.shift to left since there are the same number molecules on both sides of the reaction 14. Kp=
=
= =121,96 x 10-12 15. FeSCN2+ (aq) ↔ Fe3+ (aq) + SNC-(g) M 2M B xM xM xM S (2-x)M xM xM
Kc=
9,1 x 10 -4 = 9,1 x 10 -4 = X2 + 9,1.10-4 – 18,2.10-4 =0 X2 = 9,1x10-4 X= √9,1x10-4 X= 0,03 M So, [Fe2+] = x = 0,03M [SCN-] = x = 0,03M [FeSCN2+] = (2-x)M = (2 - 0,03 ) = 1,97 M 16. a.
.
(K1) =
2 x 10-25
= 0,4 x 10-4 = 4 x 103 b.
.
(K1)(K2) =
2 x 10-25) (2 x 10-5)
= 8 x 10-2 c.
.
(2K2)=
(2x 2 x 10-5)
= 8 x 1023
17. Kp =
=
18. Kp pada suhu 300K Kp = Kc (RT)∆n 2,16 x 10-3 = Kc (0,082 x 300K)0 Kc = 2,16 x 10-3 Kp pada suhu 500K Kp = Kc (RT)∆n Kp= 2,16x10-3 (0,082 x 500 K)0
Kp =2,16 x 10-3 19. ∆G0f = RT In Kp -3976 kalori mol-1 = 0,082 x 298 K In Kp -3976 kalori mol-1 = 24,436 In Kp Kp = -162,71
20. PCl5 ↔ PCl3 + PCl2 .
1.PV = nRT → V= = 2Rh 2. n=
=
=
= 12 mol
nCl2 = 12 mol – 6 mol = 6 mol 21. a.- n1=
-
=
n2=
NH3 →
= 0,0018 mol
= 0,0015 mol
=
N2 +
H2
M 0,0018 B 0,0015 S
0,0003 (3 x 10-4) Q= m x c x ∆T = 1 x 4,2 x 500C =210 j ∆H=
= 700 kJ b.Ttotal = T2 – T1 = 00 C – (-50) 0C = 500C Maka suhu normal adalah = 500C + 1000C = 1500C
TUGAS RUTIN BAB 3 HALAMAN 50 1. Bahan pembasmi nyamuk yang terkenal , DDT, mempunyai rumus molekul C 14H9Cl5. Dalam tubuh nyamuk DDT mengalami metabolisme dan menghasilkan DDD dengan susunan 52,5% C, 3,15%H, dan 44,4% Cl dengan berat molekul 320. Tentukan rumus empiris dan rumus molekul DDD! (Ar C = 12, Cl = 35,5 dan H = 1) Penyelesaian : Diketahui : CmHnOp RUMUS EMPIRIS m= = = 4,37 % = 4 (pembulatan)
n= = = 3,15 % = 3 (pembulatan) p= = = 1,25 % = 1 (pembulatan) Sehingga CmHnOp = C4H3O RUMUS MOLEKUL C4H3O = 340 48x + 3x +16 x = 340 67x = 340 x x x
= = 5,07 = 5 (pembulatan)
2. Pada pembakaran sempurna 18 gram senyawa karbon yang hanya terdiri dari unsur Karbon, Hidrogen dan Oksigen akan menghasilkan 26,4 gram karbon dioksida dan 10,8 gram air. Tentukan rumus empiris dari senyawa karbon tersebut! (Ar C = 12, O = 16 dan H=1) Penyelesaian : CXHYOZ + O2
CO2 + H2O
m CXHYOZ m CO2 m H2O
= 18 gram = 26,4 gram = 10,8
C dalam CO2
=
x m CO2
C dalam CO2
=
x 26,4 gram
C dalam CO2
= 7,2 gram
H dalam H2O
=
x m H2O
H dalam H2O
=
x 10,8 gram
H dalam H2O
= 1,2 gram
mO
= m CXHYOZ – ( m C + m H )
mO
=18 gram – (7,2 gram + 1,2 gram)
mO
=18 gram – ( 8,4 gram )
mO
= 9,6 gram
DALAM PERSEN C
=
C
=
C
= 40 %
H
=
H
=
H
= 6,6 %
O
=
O
=
O
= 53,3 %
x 100% x 100%
x 100% x 100%
x 100% x 100%
RUMUS EMPIRIS C
=
C
=
C
= 3,33
H
=
H
=
H
= 6,6
O
=
O
=
O
= 3,33
C 3,33 1 1
: : : :
H 6,6 1,98 2
: : : :
O 3,33 1 1
CH2O 3. Lengkapi koefisien reaksi dari reaksi berikut : a. Ag2S + HNO3
AgNO3 + S + NO2 + H2O
b. K4Fe(CN)6 + H2SO4 + H2O c. KMnO4 + H2SO4 + H2C2O4
K2SO4 + FeSO4 + (NH4)2SO4 + CO K2SO4 + MnSO4 + CO2 + H2O
Penyelesaian : d. 2 Ag2S + 3 HNO3
4 AgNO3 + S + 4 NO2 + 4 H2O
e. K4Fe(CN)6 + 6 H2SO4 + 6 H2O f.
2 K2SO4 + FeSO4 + 3 (NH4)2SO4 + 6 CO
2 KMnO4 + 3 H2SO4 + 5 H2C2O4
K2SO4 + 2 MnSO4 + 10 CO2 + 8 H2O
4. Tuliskan persamaan reaksi molekul dan reaksi ionik dari reaksi berikut : a. Kalium iodida dicampur dengan timbal nitrat b. Logam tembaga dilarutkan dalam larutan asam nitrat pekat c. Logam seng dicelupkan ke dalam larutan asam sulfat encer Penyelesaian : a) Reaksi molekul 2 KI + Pb(NO3)2
2 KNO3 + PbI2
Reaksi ionic Pb2+ + 2 NO32- + 2 K2+ + 2 I-
2 NO32- + 2 K2+ + PbI2
b) Reaksi Molekul Cu + 2 HNO3
Cu(NO3)2 + H2
Reaksi ionic Cu + 2 H+ + 2 NO3-
Cu(NO3) + 2 H+
c) Reaksi molekul 2 Zn + 2 H2SO4
Zn2(SO4)2 + 2 H2
Reaksi ionik 5. Kadar urea (CO(NH2)2 dalam suatu pupuk urea adalah 46%. Tentukan kadar nitrogen dalam pupuk urea tersebut! (Ar C=12, O=16 N=14 dan H=1) Penyelesaian : (CO(NH2)2 = 46% Mr = 60 %N
=
%N
=
%N
=
%N
= 21,5 %
6. Seorang petani ingin memupuk 1 hektar ladangnya dengan pupuk TSP sehingga tiap meter persegi ladang itu mendapat tambahan 1 gram fosfor. Jika kadar Ca(H 2PO4)2 dalam TSP adalah 98%. Hitung berapa kg pupuk TSP yang dibutuhkan oleh petani tersebut (Ar Ca=40, P=31, O=16 dan H=1) Penyelesaian : Untuk memupuk 1 ha (10.000 m2 ) maka, diperlukan massa nitrogen sebagai berikut. Massa nitrogen = 1,4 gram x 10.000 = 14.000 gram Maka massa urea yang dibutuhkan adalah Massa N
=
x massa CO(NH2)2
Massa CO(NH2)2 = Massa CO(NH2)2 = Massa CO(NH2)2 = 60.000 gram Massa CO(NH2)2 = 60 kg Jadi, massa urea yang dibutuhkan adalah 60 kg 7. Sebuah perusahaan pembangkit listrik menggunakan 6600 ton batubara per hari sebagai bahan bakar. Di dalam batubara tersebut kadar belerang sekitar 1,6% massa. Selain energi yang dihasilkan dari pembakaran batubara, belerang akan teroksidasi menjadi belerang dioksida yang merupakan salah satu sumber polusi udara, untuk mengurangi resiko lepasnya polutan ini ke udara, digunakan kalsium oksida sebagai penyerap sehingga terbentuk kalsium sulfit (Ar S=32, O = 16 dan Ca=40) dengan kemapuan daya serap kalsium oksida adalah sekita 85% massa belerang dioksida. Hitung berapa ton kalsium oksida yang dibutuhkan oleh perusahaan tersebut per hari! Answer m kalsium = 6600 x 85% m kalsium = 5610 w Ca
=
w Ca
=
x 5610
w Ca = 4.007 ton 8. Dalam proses Solvay, untuk menghasilkan natrium karbonat, Na 2CO3 reaksi berikut terjadi secara berurutan : NH3 + CO2 + H2O
NH4HCO3
NH4HCO3 + NaCl
NaHCO3 + NH4Cl
2 NaHCO3
Na2CO3 + CO2 + H2O
Berapa ton natrium karbonat akan diproduksi per ton NH 3, Jika proses itu 100% efisien ? Penyelesaian :
NH3 + CO2 + H2O
NH4HCO3
n NH3 = n NH3 = 58,8 n NH4HCO3 = 58,8 NH4 HCO3 + NaCl
NaHCO3 + NH4Cl
n NH4 HCO3 = 58,8 n NaHCO3 = 58,8 2 NaHCO3
Na2CO3 + CO2 + H2O
n NaHCO3 = 2 x 58,8 n NaHCO3 = 117,6 n Na2CO3 =
x 117,6
n Na2CO3 = 58,8 gram Na2CO3 = n x Mr Na2CO3 gram Na2CO3 = 58,8 x 106 gram Na2CO3 = 6.232,8 kg gram Na2CO3 = 6,2328 ton 9. Hitunglah jumlah gamping, CaO, yang akan dibuat dengan memanaskan 200 kg batu kapur yang mempunyai kemurnian CaCO3 95% ! Penyelesaian : CaCO3
CaO + CO2
Massa CaCO3 =
x 200
Massa CaCO3 = 190 Mol CaCO3
=
Mol CaCO3 = 1,9 Kmol Dengan perbandingan koefisien maka diperoleh Mol CaO = 1,9 Kmol Massa Cao = 1,9 x 56 Massa Cao = 106,4 gram 10. Kloropikrin dapat digunakan sebagai insektisida dengan biaya murah melalui proses yang menggunakan reaksi : CH3NO3 + 3 Cl2
CCl3NO3 + 3 HCl. Berapa banyak nitrometana
yang dibutuhkan untuk membuat 500 gram kloropikrin ? Penyelesaian : CH3NO3 + 3 Cl2
CCl3 NO3 + 3 HCl
n CCl3 NO3 = n CCl3 NO3 = n CCl3 NO3 = 2,8 Karena pebandingan koefisien antara CCl3 NO3 dengan CH3NO3 sama maka mol(n) sama
n CH3NO3
=
2,8
=
Gram CH3NO3 = 210 gram. 11. Sebotol zat Kalium Permanganat (KMnO4) tercapur dengan sedikit Kalium Klorida (KCl). Bila sebanyak0,586 gram KMnO4 yang tidak murni tersebut dilarutkan dalam basa, dan kemudian direaksikan dengan asam oksalat, Mn dalam contoh tersebut secara kuantitatif berubah menjadi Mangan Dioksida (MnO 2) seberat 0,297 gram. Berapa % berat KMnO 4 contoh diatas (Mr KMnO4 = 158, MnO2 = 87) Penyelesaian : KMnO4 + KCl
KMnO4 + KCl
gr= 0, 586 KMnO4 + C2H4 2MnO2 + K2CO3 + H2O + CO2 n gram
= 0,0034 = 0,0034 x 158 = 0,53720 gram
n 2MnO2
= = 0,5034
%
=
x 100%
%
= 1,09 %
12. Sebanyak 100 mL air garam yang berisi NaCl, direaksikan dengan perak nitrat berlebih menghasilkan 7,175 gram endapan perak klorida menurut persamaan : NaCl (aq) + AgNO3(aq)
AgCl (s) + NaNO3(aq)
Jika massa jenis air garam itu adalah 1,03 kg/L, hitung berapa persen kadar NaCl dalam air garam tersebut (Ar Na = 23; Cl = 35,5; Ag=108) Penyelesaian : Diketahui : P = 1,03 kg/L NaCl (aq) + AgNO3(aq) n AgCl
=
n AgCl
=
n AgCl
= 0,05 mol
AgCl (s) + NaNO3(aq)
M
=
M
=
M
= 5 x 10-4
M
=
5 x 10-4= %
=
%
= 550,3 %
13. Suatu campuran NaCl dan KCl bobotnya 5,4892 gram. Contoh itu dilarutkan didalam air dan direaksikan dengan larutan perak nitrat yang berlebih. AgCl yang terbentuk ditimbang, bobotnya 12,7052 gram. Berapakah persentase NaCl dalam campuran tersebut ? Penyelesaian : NaCl + KCl 5,4892 gram NaCl + KCl + AgNO3
AgCl + NaCl + KNO3
n
12,7052
= 5,4892 gram
% = % = 0,9 % 14. Pada banyak negara, seseorang secara hukum dinyatakan mabuk jika dalam darahnya tekandung etil alkohol ( C2H5OH) dengan konsentrasi 0,1 gram ( atau lebih) per desiliter. Nyatakan konsentrasi etil alkohol tersebut dalam satuan mol.L -1. Diketahui : [C2H5OH] = 0,1 g/ dL. Mr C2H5OH = 46. Ditanya : [C2H5OH] dalam mol/ L =……? Penyelesaian : [C2H5OH] = 0,1 g/ dL = 0,1 g/ 0,1 L = 1 g/ L. m = mol = g/ Mr = 1 g / 46 g/mol = 0,02 mol. Maka konsentrasi etil alkohol adalah 0,02 mol/ L.
15. Hitung berapa gram jumlah air yang harus ditambah pada 5,00 gram urea (CO (NH 2)2) untuk membuat larutan 16,2 % berdasarkan massa. Diketahui : m urea = 5 gram = 16,2 % Ditanya : g air =……? Penyelesaian : % m air = ( 100- 16,2 ) % = 83, 8% m air = m urea x %air/ % urea = 5 g x 83,8 % / 16,2 % = 5 g x 5,172 = 25, 86 g air. 16. Suatu larutan berair asam hidroklorida mengandung 38 % asam hidroklorida berdasarkan massa. Rapatannya ialah 1, 1886 g.cm -3 pada suhu 20 oC. hitunglah : a) molaritas larutan, b) molalitas larutan dan, c) fraksi mol asam hidroklorida Diketahui : m HCl = 38%, Mr HC l = 36, 5 HCl
= 1,1886 g.cm-3
T = 20 0 C Ditanya : a) M =………? b) m =………? c) XHCl =……? Penyelesaian : Massa larutan = 1000 ml x
HCl
= 1000 x 1,1886 = 1188,6 gram HCl dalam 1 L larutan = 38 % x 1188,6 = 451, 67 g. Mol HCl = g / Mr = 451, 67 / 36, 5 = 12, 37 mol Jumlah air dalam larutan ( m air ) = massa larutan – massa HCl = (1188,6 - 451, 67) g = 736,93 g m air = 0,73693 kg mol air
= g / Mr H2O = 736,93 / 18 = 40, 94 mol.
a) M = mol HCl/ 1 liter larutan = 12,37 / 1 = 12,37 M b) m = mol HCl / massa air = 12, 37 / 0,73693 = 16, 78 m c) XHCl = mol HCl / mol HCl + mol air = 12,37 mol / (12,37 + 40, 94 ) mol = 12,37 / 53, 31 = 0,23 .
17. seorang pasien memiliki “tingkat kolesterol” 214. Sebagaimana pengukuran kimia darah lazimnya, hasilnya dinyatakan dalam satuan mg.dL-1. Pertanyaan: a. tentukan molaritas kolesterol dalam darah pasien, jika massa molar kolesterol adalah 386,64 g.mol-1. b. perkirakan molalitas kolesterol dalam darah pasien, dan c. tentukan volume darah pasien yang dibutuhkan untuk memperoleh 8,10 gram kolesterol. Jawab: dik :
[kolesterol] = 214 ppm
Mr kolesterol = 386,64 g. Mol-1 Dit : a. [kolesterol] = ... b. m = ... c. V = ... Dij : a. 214 ppm = 214 mg kolesterol dalam 1 liter larutanya M=
=
=
= 0,00055 M
b. m = = = 0.55349 mol/kJ c. mol =
=
= 0,02 mol
mol = V . M 0,02 = V . 0,00055 V = 36,36 L 18. untuk menetapkan kadar asam sitrat yang terdapat dalam minuman, sebanyak 50 mL sampel minuman dititras dengan larutan NaOH 0,04166 M. Untuk mencapai titik ekivalen dengan menggunakan indikator fenolftalein, dibutuhkan larutan NaaOH sebanyak 17,62 mL. Hitung berapa %b/v kadar asam sitrat dalam minuman tersebut! Jawab : C6H8O7 + NaOH
Na3C6H8O7 + 3 H2O
Mol NaOH = V . M = 17,62 mL . 0,04166 M = 0,73 mmol = 7,3 . 10-4 mol 3 mol NaOH = mol C6H8O7 Mol C6H8O7 = 3 . 7,3 . 10-4 = 21,9 . 10-4 mol Massa C6H8O7
= Mr. Mol =192x21,9.10-4 = 0,42 gram
= 0,84 % 19. tuliskan persamaan yang menghubungkan Ka suatu asam dengan Kb basa konjugasinya. Gunakan NH3 dan NH4+ sebagai contoh! Jawab : H2O + NH3
NH4+ + OH-
20. Hitunglah pH dari larutan HCN 1.10-4M, bila diketahui pKa HCN=9,4. Pembahasan: Dik: Ka=9,4 Ma= 1.10-4 Dit: hitunglah pH larutan? Jawaban [H+]]= [H+]=
[H+]= [H+]=3,06. 10-2 M pH= -log[H+] = -Log 3,07 . 10-2 = 2-log 3,07
:
=2- 0,49 = 1,51 21. Hitunglah pH dari larutan NH4CL 0,02 M, bila diketahui Kb NH3= 1,8.10-5 Pembahasan: Dik: Kb= 1,8.10-5 2.10-2
M= 0.02M
Dit: hitunglah pH larutan? Jawaban
:
[OH-]= [OH-]=
[OH-]= [OH-]=
M
[OH-]=6.10-4 POH= -log[OH-] =-Log 6.10-4 = 4-log 3,07 =4- log 6 pH= 14-(4 –log6) = 10+ log 6 22. Sebanyak 4,1 gram natrium asetat, CH 3COONa(Mr=82) dilarutkan dalam air hingga volume larutan 500ml. Jika Ka CH 3COOH=10-5. Tentukan pH larutan dan persen hidrolisisnya! Pembahasan : m CH3COONa: 4,1 gram Mr CH3COONa: 82 gram/mol Volume larutan: 500 mL= 0,5 L Ka CH3COOH:10-5, Kw = 10-14 Dit: pH larutan dan persen hidrolisisnya ?
mCH3COONA =
=
=0,02 mol M CH3COONa=
= = 0,1 M
[OH-]=
=
= =10-8 POH= -log [OH-] = - log [10-8] = 8 Ph larutan= 14-POH =14 – 8 = 6 23. Suatu larutan buffer formiat dengan pH 4, dibuat dengan cara mencampurkan larutan HCOOH 0,2 M dengan larutan HCOONa 0,3 M . Jika K a HCOOH= 2.10-4, tentukan perbandingan volume HCOOH dan HCOONa dalam campuran. Penyelesaian: Jumlah mol HCOOH = 0,2 V1 Jumlah mol HCOONa = 0,1 V2 Nilai pH = 4
[H+] = 10-4
Ka HCOOH= 2.10-4
[H+] =
10-4 =
1 = V1 : V2 = 4:3 24. Ke dalam 50 mL larutan buffer yang terdiri dari campuran NH 3 0,2 M dan NH4Cl 0,1 M ditamvahkan 0,5 mL larutan HCl 0,1 M. hitung pH dari larutan buffer tersebut setelah penambahan asam pKa NH4+ = 9,26. Penyelesaian : [NH3] = 0,2 M [NH4] = 0,1 M V campuran = 50mL Sebelum penambahan HCl [H+] =
= 10-9,16
maka di peroleh pH = 9,16
Sesudah penambahan HCl [H+] =
= 10-909 maka diperoleh pH = 9,09
Maka pH setelah penambahan HCl = 9,16 – 9,09 = 0,07 25. Misalkan anda diminta membuat sistem buffer untuk darah tiruan dan menginginkan agar buffer tersebut mampu mempertahankan darah pada pH yang sebenarnya yaitu : 7,4. Jika hal-hal yang lainnya sama, manakah sistem buffer yang anda lebih sukai : H2CO3/HCO3- atau H2PO4-/HPO42-. Jelaskan! Penyelesaian : Pada cairan intra sel, kehadiran larutan buffer fosfat sangat penting dalam mengatur pH darah. Larutan buffer ini berasal dari campuran dihidrogen fosfat (H 2PO4-) dengan monohidrogen fosfat (HPO32-). Buffer fosfat dapat mempertahankan pH darah 7,4. Larutan buffer diluar sel hanya sedikit jumlahnya tetapi sangat penting untuk larutan penyangga urin. TUGAS RUTIN HALAMAN 10 (BELAKANG)
1. A solution of phosphoric acid was made by dissolving 10.0 g H 3PO4 in 100.0 mL water . The resulting volume was 104 mL.Calculate the density, mole fraction, molarity and molality of the solution. Assume water has a density of 1.00 g/cm 3. Diketahui : H3PO4 + H2O → H2PO4- + H3O + mH3PO4 = 10 g V1 = 100 mL = 10 L V2 = 104 mL AIR
= 1.00 g.cm-3
Ditanya : a)
=………?
b) X =………? c) M =…….…? d) m =………? Penyelesaian : n H3PO4 = g/ Mr = 10/ 98 = 0,1 mol AIR
= 1.00 g.cm-3 = 1 g. mL
m/ v = 1 g. mL m/ 100 mL = 1 g. mL m = 100 g n H2O = g / Mr = 100 g/ 18 g/mol = 5,5 mol. a)
=m/v
= 10 g/ 100 mL = 0,1 g/ mL b) X = n H3PO4 / n H3PO4 + n H2O = 0,1 / 0,1+ 5,5 = 0,017 mol c) M = m/ Mr x 1000/ v = 0,1 mol x 1000/ 100 =1M d) m = mol H3PO4 / massa berat = 0,1 mol / 0,1 = 1 m. 2. An aqueous antifreeze solution is 40 % ethylene glycol ( C 2H6 O2) by mass. The density of the solution is 1.05 g/cm -3. Calculate the molality, molarity and mole fraction of the ethylene glycol. Diketahui : mC2H6 O2= 40 % = 1, 05 g/cm Ditanya : a) m =………? b) M =…….…? c) X =………? Penyelesaian : Massa larutan = 1000 ml x
= 1000 x 1,05 = 1050 gram C2H6 O2dalam 1 L larutan = 40 % x 1050 = 420 g. Mol C2H6 O2 = g / Mr = 420 g / 62 g/ mol = 6, 77 mol Jumlah air dalam larutan ( m air ) = massa larutan – massa C 2H6 O2 = (1050 - 420 ) g = 630 g m air = 0,63 kg mol air
= g / Mr H2O = 630 / 18 = 35 mol. a) m = mol C2H6 O2 / massa air = 6, 77 mol / 0,63 = 10, 74 m b) M = mol C2H6 O2 / 1 liter larutan = 6, 77 mol / 1L = 6,77 M c) X = mol C2H6 O2 / mol C2H6 O2+ mol air = 6, 77 / 6, 77 + 35 = 6,77 / 41,77 = 0,162 3. The lattice energy*of Nal is -686 kj/mol, and the enthalpy of hydration is -694 kj/mol. Calculate the enthalpy or solution per mole of solid Nal. Describe the process to which this enthapy change applies. Answer : = - 604 kJ/mol = - 694 kJ/mol Dit :
=.......?
=(
)+(
)
= 694+604 =1294 kj/mol 4. Although AI(HO)3is insoluble in water, NaOH is very soluble. Explain in terms of lattife energies. Answer : AI(0H)3 has a-3 charge NaOH has a-1 charge The NaOH has a weaker lattice energy so it would be easier for hydration to occur. For AI(OH)3 it has a stronger lattice energy so it will be harder for hydration to accour.
5. Which solvent water or carbon tetracloride, would you choose to dissolve each of the following ? a. KrF2b
b. MgF2 c. SF2 d. CH2O
e.SO2
f. CH2PCH2
g.CO2
Penyelesaian : When you draw the Lewis Structure for SF 2 you come up with a bent shaped molecule. This tells you that it is a polar covalent molecule and that it would dissolve better in water. CO2 on the other hand is a non-polar covalent molecule (It's shape is linear based on it's Lewis structure). This means that it will be more soluble in CCl4. 6. The solubility of nitrogen in water is 8,21.10 -4mol/L at 00C when the N2 pressure above water is 0,709 atm. Calculate the Henry’s law constant for N 2 in units of mol/L. atm for henry’s law the form C=kP, where C is the gas concentration in mol/L. Calculate the solubility of N2 in water when the partial pressure of nitrogen above water is 1.10 atm at 00C. Penyelesaian: 8,21 x 10-4 = 0,79 x k K=
= 1,03 x 10-2
C = k. 1,10 atm C = 1,03 x 10-2 . 1,10 atm C = 1,133 x 10-2 2) calculate the solubility of O2 in water at a partial pressure of O 2 of 120 torr at 25°C. The Henry’s law constant for O 2 is 1,3 . 10-3 mol/L.atm for Henry’s law in the form C = kP, where C is the gas concentration (mol/L). Jawab : Diketahui : P = 120 atm = 120 torr
T = 25°C
K = 1,3 . 10-3 mol/atm
Ditanya : C = [O2] = kP C = 1,3 . 10-3 . 120 C = 156 . 10-3 6. Glycerin, C3H8O3, is a nonvolatile liquid,. What is the vapor pressure of a solution made by adding 164 g glycerin to 338 Ml H2O at 39, 8 0C? The vapor pressure of pure water at 39, 8 0C is 54.74 torr and its density is 0,992 g/cm3. Jawab : Diketahui :
mt = 164 gram T = 39,80C air
Vp = 338 mL Pp = 54,74 atm
= 0,992 g/cm3
Mr air = 18
Mr C3H8O7 = 92 Ditanya : PL = ... Dijawab : PL = Xp . Pp =
. Pp
=
. 54,74
= 54,22 atm 7. The vapor pressure of a solution containing 53.6 g glycerin ( C 3 H8 O3) in 133.7 g ethanol ( C2 H5 OH ) is 113 torr at 40 oC. Calculate the vapor pressure of pure ethanol at 40 o C assuming that glycerin is a nonvolatile, nonelectrolyte solute in ethanol. Diketahui : mt C3 H8 O3 = 53.6 g, Mr C3 H8 O3 = 92 mp = 133.7 g, Mr C2 H5 OH = 46 P ( C2 H5 OH ) = 113 atm T= 40 oC. Ditanya : ΔP = ... Penyelesaian : ΔP = P0 Xt
ΔP = 113 .
ΔP = 113 . 0,166 ΔP = 18,78 atm 8. The normal boiling point of methanol is 64,70C. A solution containing a nonvolatile solute dissolved in methanol has a vapor pressure of 710.0 torr at 64,7 0C. What is the mole fraction of methanol in this solution? Penyelesaian: Tekanan parsial methanol tergantung padafraksi molnya. Tekanan uap methanol pada titik dididh normal adalah 760 torr. Maka : P(methanol) = X(methanol). P(murni) X(methanol)=
X(methanol)=
= 0,091
9. At a certain temperature the vapor pressure of benzene C 6H6 is 0.930 atm. A solution was prepared by dissolving 10.0 g of a nondissociating, nonvolatile solute in 78.11 g of benzene at that temperature. ? The vapor pressure of the solution was found to be 0,900 atm. Assuming the solution behaves ideally, determine the molar mass of the solute. Jawab : Diketahui : Pp = 0,930 atm mt = 10,0 gram PL = 0,9 atm mp = 78,11 gram Mrp = 78 Ditanya : Mrt = ... Dijawab: PL = Xp . PP 0,9 =
. 0,930 = =
=
-
= Mr =
= 299,87
11. A solution is made by dissolving 25,8 g urea (CH 4N2O), a nonelectrolyte, in 275 g water. Calculate the vapor pressures of this solution at 25 is 23,8 torrr at 25
and 45
and 71,9 torr at 45
Answer n H2O
=
V
=
n H2O
=
0,275
=
n H2O
= 15,27
P
=
V
=
P
= 204,8
( the vapor pressure of pure water
0,275
=
P
=
P
= 113,8
12. a solution is prepared by dissolving 27 g urea, (NH 2)2CO, in 150 g water. Calculate the boiling point of the solution. Urea is a nonelectrolyte. Answer m=
m=
x
x
m=3
∆Tb = Kb.m
∆Tb = 0,09 . 3 ∆Tb = 0,27
13. A 2 g sample of a large biomolecule was dissolved in 15 g carbon tetrachloride. The boilng point of this solution was determined to be 77,85
. Calculate the molar mass of the biomolecule.
For carbon tetrachloride, the boiling-point constant is 5,03
kg/mol, and the boiling-point of pure
carbon tetrachloride is 76,50 Answer n =
5,03 =
Mr = Mr = 0,39 x 77,85 Mr = 30,36 14. what mass of glycerin (C 3H8O3), a nonelectrolyte, must be dissolved in 200 g water to give a solution with a freezing point of -1,50 Answer Tf = - 1,50 ◦C
?
∆Tf = Tf – T’f = 0 – (- 1,50) = 1,50 ◦C Kf = 1,86 ◦C/ m ∆Tf = m . Kf 1,50 = ( m/Mr x 1000/mair) x 1,86 1,50 = ( m/92 x 1000/200) x 1,86 1,50 = (m/92 x 5) x 1,86 1,50 =( 5m/ 92 ) x 1,86 138 = 9,3 m m
=
m = 14, 83 gr 15. The freezing point of t-butanol is 25.50
and Kf is 9,1
.kg/mol. Usually t-butanol absorbs
water on exposure to air. If the freezing point of a 10 g sample of t-butanol is 24,59
, how many
grms of water are present in the sample? Answer ΔTf = Kf x m x i ΔTf = Kf x m 0,91ºC = (9,1 ºC * kg / mol) x m m = 0,10 mol / kg Jadi ada sepersepuluh satu tetes air hadir untuk setiap kilogram pelarut. Jumlah zat terlarut awalnya hadir adalah 10,9 g, atau 0,0109 kg. 0,10 m = (mol) / (0,0109 kg) (mol) = 1,1e-3 mol Sekarang kita hanya mengubah mol air menjadi gram air, menggunakan massa molar air, yaitu 18,02 g / mol. 1.1e-3 mol x (18,02 g) / (1 mol) = 2,0e-2 g H2O. 16. calculate the freezing point and boiling point of an antifreeze solution that iss 50% by the mass of ethylene glycol (HOCH2CH2OH) IN WATER. Ethylene glycol is a nonelectrolyte.
Answer Moles = 50 g / 62 g/mol= 0.806 m = 0.806 / 0.050 Kg = 16.1 delta T = 16.1 x 1.86 = 29.9 freezing point = - 29.9 *C delta T = 16.1 x 0.512 = 8.24 boiling point = 108.24 °C 17. what volume of ethylene glycol (C2H6O2), a nonelectrolyte, must be added to 15 L water to produce an antifreeze solution with a freezing point -25
? what is the boiling point of this
solution ? (the density of ethylene glycol is 1,11 g/cm 3, and the density of water is 1 g/cm3.) Answer Rumusnya adalah delta T = i m K di mana saya adalah nomor van'tHoff, dalam hal ini 1 karena itu adalah nonelectrolyte; m adalah molalitas dalam tahi lalat / Kg; dan K adalah titik depresi titik beku konstan untuk air yang -1,86. Delta T = -25 derajat, jadi pecahkan untuk m; m = -25 / -1,86 = 13,44 molal Ini berarti 13,44 mol / Kg dan Anda memiliki 15 L yang = 15 Kg sehingga Anda memiliki 13,44 mol / Kg x 15 Kg = 201,6 mol. Massa molar dari ethylene glycol adalah 62gm / mol sehingga 62gm / mol x 201.6 mol = 12499 gram. density = 1.11gm / ml sehingga 12499gm / 1.11gm / ml = 11260 ml diperlukan. Gunakan rumus yang sama untuk mendapatkan titik didih tetapi gantikan nilai K = 0,512 18. From the following: Pure water, solution of C11H22O11 (m = 0,01) in water, solution of NaCl (m = 0,01) in water, solution of CaCl2 (m = 0,01) in water, choose the one with the a. highest freezing point. b. lowest boiling point. c. lowest freezing point , d highest osmotic pressure, e. highest boiling point. Answer Pertimbangkan solusi berikut. I. air murni II. larutan C12H22O11 (m = 0,01) dalam air larutan NaCl (m = 0,01) dalam air IV. larutan CaCl2 (m = 0,01) dalam air (a) Pilih yang memiliki titik beku tertinggi. air murni Solusi C12H22O11 Larutan NaCl Larutan CaCl2
(B) Pilih satu dengan titik beku terendah. air murni Solusi C12H22O11 Larutan NaCl Larutan CaCl2 (C) Pilih satu dengan titik didih tertinggi. air murni Solusi C12H22O11 Larutan NaCl Larutan CaCl2 (D) Pilih satu dengan titik didih terendah. air murni Solusi C12H22O11 Larutan NaCl Larutan CaCl2 (E) Pilih satu dengan tekanan osmotik tertinggi. air murni Solusi C12H22O11 Larutan NaCl Larutan CaCl2 19. calculate the freezing point and the boiling point of each the following solution : (assume complete dissociation.) a. 50 g NaCl in 25 g H2O, b. 2 g Al(NO3)3 in 15 g H2O Answer Untuk penggunaan depresi titik beku: ΔT = i Kf m Untuk penggunaan elevasi titik didih: ΔT = i Kb m Penjelasan variabel: ΔT = depresi titik beku. i = van't Hoff factor = jumlah partikel yang berasal dari masing-masing unit rumus. Kf = titik beku depresi konstan. Kb = konstanta elevasi titik didih. m = molalitas = mol terlarut / pelarut kg. NaCl berdisosiasi menjadi ion Na ^ + dan Cl ^ - i jadi i = 2 Al (NO3) 3 berdisosiasi menjadi 1 ion Al ^ 3 + dan 3 NO3 ^ - ion jadi saya = 4 Kf untuk H2O = 1,858 ° C / m Kb untuk H2O = 0,521 ° C / m tahi lalat NaCl = (5,0 g) / (58,44 g / mol) = 0,0856 mol Moles Al (NO3) 3 = (2,0 g) / (212,996 g / mol) = 0,00939 mol molality NaCl = (0,0856 mol) (0,025 kg) = 3,424 molal molality Al (NO3) 3 = (0,00939 mol) / (0,015 kg) = 0,626 molal
Untuk NaCl: ΔT = i Kf m = (2) (1,858 ° C / m) (3,424 m) = 12,7 ° C ΔT = Tf (pelarut murni) - Tf (solusi) 12,7 ° C = 0,0 ° C - Tf (solusi) Tf (solusi = -12,7 ° C Untuk Al (NO3) 3 gunakan i = 4. Metode perhitungan akan sama. Untuk NaCl: ΔT = i Kb m = (2) (0,521 ° C / m) (3,424 m) = 3,57 ° C ΔT = Tb (solusi) - Tb (pelarut murni) 3,57 ° C = Tb (solusi) - 100,00 ° C Tb (solusi) = 103,57 ° C 20. A Water desalination plant is set up near a salt marsh containing water that is 0,1 M Calculate the minimum pressure that must be applied at 25
to purify the water by reverse
osmosis. Assume NaCl is completely dissociated. Answer The osmotic pressure of a dilute solution can be approximated using the morse equation. ∏= iMRT Where i is the dimensionless van’t Hoff factor M is the molarity R= 0,08206 L. atm. Mol-1. K-1 is the gas Constant T is the thermodynamic (absolute) temperature For NaCl, i= 2, therefore ∏= 2 x 0,1 x 0, 08206 x ( 25 + 273 . 15 ) = 4,9 atm
NaCl.
BAB IV TERMODINAMIKA KIMIA LATIHAN SOAL HAL 56 1. Sebuah penangas listrik menghasilkan kalor sebesar 15 kkal perubahan energi dalam sebesar kJ. Berapakah kerja yang bekerja pada sistem tersebut. Penyelesaian : Dik : Sistem adalah penangas listrik Q = - 62,802 kJ (membebas kalor) ; 1kkal = 4,184 kJ U = 32 kJ Dit :W ? Jawab : U = Q + W W= U–Q W = 32 – (-62,802) W= 94,802 kJ 2. Satu mol gas sempurna dipanaskan sehingga sistem menyerap kalor sebesar 30 kJ, sekaligus melakukan kerja terhadap lingkungannya sebesar 45 kJ. Berapakah harga perubahan energi dalam. Penyelesaian: Dik :Q = 30 kJ ( menyerap kalor) W = - 45 kJ (melakukan kerja) Dit : U? Jawab : U = Q + W U = 30 + (-45) kJ U= - 15 kJ LATIHAN SOAL HAL 61 1. 50 ml larutan HCl 0,1 M pada temperature 25 NaOH 0,1 M pada temperature 25
dicampurkandengan 25 ml larutan
dalam beaker plastik. Hasil pencampuran
memiliki temperatur 32
, bila diketahui cair = 4,18 J/gr
. Berapakah harga kalor
penetralan? Penyelesaian : Dik : V HCl = 50 ml
t1 = 25
M HCl = 0,1 M
t2 = 32
mol HCl = 5 mmol
cair = 4,185 J/gr
Dit
V NaOH = 25 ml M NaOH = 0,1 M mol NaOH = 2,5 mmol : H?
Jawab : Vcamp = V HCl + V NaOH
mcamp = V
1 g/ml
= 50 ml + 25 ml
= 75 ml
= 75 ml
= 75 g
T = (t2 – t1)
1g/ml
= (32 - 25) =7
Q=m.c. T = 75 g . 4,18 J/g
.7
= 2194,5 J = - 2194,5 J (eksoterm) HCl(aq) + NaOH(aq) M= B = S =
5 mmol 2,5 mmol 2,5 mmol 2,5 mmol 2,5 mmol -
H = -2194,5 :
NaCl(aq) + 2,5 mmol 2,5 mmol
H2O(l) 2,5 mmol 2,5 mmol
= -877.800 J = - 877,8 kJ
2. 50 ml larutan CH3COOH 0,1 M pada temperatur 27 larutan KOH 0,05 M pada temperature 26 pencampuran memiliki temperatur 30
dicampurkan dengan 50 ml
dalam beaker plastik. Hasil
, bila diketahui cair = 4,18 J/gr
harga kalor penetralan? Penyelesaian : Dik : V CH3COOH = 50 ml
t1 = 27
M CH3COOH = 0,1 M
t2 = 30
mol CH3COOH = 5 mmol
cair = 4,18 J/gr
V KOH = 50 ml
. Berapakah
Dit
M KOH = 0,05 M mol NaOH = 2,5 mmol : H?
Jawab : Vcamp = V CH3COOH + V KOH
mcamp = V
1 g/ml
= 50 ml + 50 ml
= 100 ml
= 100 ml
= 100 g
1g/ml
Q=m.c. T = 100 g . 4,18 J/g
. (30 – 26,5)
= 1463 J CH3COOH(aq) + KOH(aq) M= B = S =
5 mmol 2,5 mmol 2,5 mmol
H = 1463 :
CH3COOK(aq) +
2,5 mmol 2,5 mmol -
2,5 mmol 2,5 mmol
H2O(l) 2,5 mmol 2,5 mmol
= -585.200 J = - 585,2 Kj
3. 2 gr logam Mg dilarutkan dalam 50 ml larutan HCl 1 M menghasilkan gas H2 dengan temperatur awal 29
dan temperatur akhir 35
bila diketahui cair = 4,18 J/gr
.
Berapakah harga kalor pembentukan gas? Penyelesaian: Dik : Mg = 2 gr
cair = 4,184 J/gr
HCl 1 M = 50 ml T=6
menghasilkan gas H2
Dit : Q kalor pembentukan gas? Jawab : Q = m . c . T = (50+2) . 4,18 . 6 = - 1,304 J 4. Seorang siswa mencampurkan 50 ml larutan HCl 1,0 M dan 50 ml NaOH 1 M dalam calorimeter yang kapasitas panasnya dapat diabaikan . Setelah reaksi , ternyata suhu larutan naik dari 21,0
menjadi 27,5
. Bila densitas larutan adalah 1,0 g/ml dan
-1
panas spesifik larutan adalah 4,18 J.g .K-1, maka hitunglah entalpi reaksi netralisasi tersebut. Penyelesaian : Dik : 50 ml HCl 1,0 M 50 ml NaOH 1,0 M
Densitas larutan = 1,0 g/ml cair = 4,18 J.g-1.K-1
T = 6,5 Dit
: H netralisasi?
Jawab :
NaOH + HCl
NaCl + H2O
nNaOH = M . V
nNaOH = nH2O 0,05 mol = 0,05 mol
= 1 . 0,05 = 0,05 mol
Q=m.c. T = 100 . 4,18 . 6,5 = - 2717 J ( eksoterm ) H=
=
= 54.340 J/mol = 54,34 kJ/mol
5. Dalam calorimeter bom yang kapasitasnya panasnya 2,71 kJ/ , sebanyak 1 gram metanol cair , CH3COH dibakar dengan gas oksigen dan menghasilkan gas CO2 dan H2O cair. Setelah reaksi selesai, suhu 2000 gram air naik dari 26 Diketahui panas spesifik = 4,184 J.g-1.
menjadi 33
-1
, tentukan nilai U reaksi untuk :
a. 1 gram metanol b. 1 mol metanol Penyelesaian : Dik
: C = 2,71 kJ/ metanol = 1 gr
Dit
T=7 cair = 4,184 J.g-1.
-1
mair = 2000 gr : U untuk a. 1 gram metanol b. 1 mol etanol
Jawab : Q = Q(kalorimeter) + Q(larutan) = (C. T) + (m . c . T) = ( 2,71.7) + (2000 . 4,184 . 7) = 18,97 + 58,576 = - 58594,97 kJ (eksoterm) a.
U 1 gram metanol U=Q = - 58594,97 kJ
b. U 1 mol metanol U = - 58594,97 kJ/g . 32 g/mol = - 1875039,04 kJ/mol
.
6. Dalam kalorimeter bom yang kapasitas panasnya 2,71 kj/
, sebanyak 4 gram
glukosa C6H12O6, dibakar dengan gas oksigen dan menghasilkan gas CO2 dan H2O cair. Setelah reaksi selesai, suhu 1000 gram air naik dari 27 Diketahui panas spesifik air = 4,184 J.g-1.
menjadi 37 .
-1
, tentukanlah nilai U reaksi
pembakaran tersebut! Penyelesaian : Dik
: C = 2,71 kJ/ mglukosa = 4 gr
Dit
T = 10 cair = 4,184 J.g-1.
-1
mair = 1000 gr : U reaksi pembakaran ?
Jawab : Q = Q(kalorimeter) + Q(larutan) = (C. T) + (m . c . T) = ( 2,71.10) + (1000 . 4,184 . 10) = 2,71 + 41840 = - 41,86 J nglukosa =
U=
= 0,02 mol
= 2.093 J/mol = 2,093 kJ/ mol
LATIHAN SOAL HAL 64 1. Berdasarkan data-data perubahan entalpi pembentukan standar yang dikemukakan dalam tabel tentukan perubahan entalpi reaksi standar untuk reaksi : Na(s) + H2O(l) NaOH(aq) + H2(g) Pembahasan : Dik : H0f Na = 0 kJ/mol H0f H2O(l) = -285,8 kJ/mol H0f NaOH(aq) = -426,8 kJ/mol H0f H2(g) = 0 kJ/mol Dit :
H0f reaksi …?
Jawab :
H0f =
H0f produk - H0f reaktan
= (-426,8 kJ/mol+0 kJ/mol)- (0 kJ/mol+(-285,8 kJ/mol)) = -426,8 kJ/mol – (-285,8 kJ/mol)
= -141 kJ/mol 2. Berdasarkan data-data perubahan entalpi pembentukan standar yang dikemukakan dalam tabel tentukan perubahan entalpi reaksi standar untuk reaksi : K(s) + H2O(l) KOH(aq) + H2 (g) Pembahasan : Dik : H0f K(s) = 0 kJ/mol H0f H2O(l) = -241,8 kJ/mol H0f H2(g) = 0 kJ/mol H0f KOH = Tidak diketahui H0f reaksi
Dit :
Jawab : Tidak dapat diselesaikan karena tidak dicantumkan tabel ataupun saat disearching tidak ada yang mencantumkan tabel secara lengkap. 3. Dari entalpi reaksi berikut ini : 2SO2(g) + O2 2SO3(g) H = -196 kJ 2S(s) + 3O2(g)
2SO3
H = -790 kJ
Berapakah perubahan entalpi pembentukan ( Hf) SO2? Jawab : Tidak dapat diselesaikan karena tidak dicantumkan tabel ataupun saat disearching tidak ada yang mencantumkan tabel secara lengkap. LATIHAN SOAL HAL 65 1. Berdasarkan data-data perubahan entalpi pembentukan standar yang dikemukakan dalam tabel tentukan perubahan entalpi reaksi standar untuk reaksi : C2H2(g) + O2(g) CO2(g) + H2O(l) Pembahasan : Dik : H0f C2H2(g) = +227 kJ/mol H0f O2(g) = 0 kJ/mol H0f CO2(g) = -393,5 kJ/mol H0f H2O(l)= -285,8 kJ/mol Dit :
H0f reaksi …?
Jawab :
H0f =
H0f produk - H0f reaktan
= (-393,5 kJ/mol+ (-285,8 kJ/mol)) - (+227 kJ/mol + 0 kJ/mol) = -679,3 kJ/mol – 227 kJ/mol) = -906,3 kJ/mol
2. Sebanyak 7,2 glukosa C6H12O6 (M=180 g/mol) dibakar sempurna dengan oksigen. Panas yang dihasilkan dari pembakaran tersebut dapat menaikkan suhu 1000 cm3 air sebesar 3,210C. Hitunglah entalpi pembakaran,
Hc glukosa bila diketahui kalor
spesifik , c H2O= 4,2 JK-1g-1 dan densitas air = 1g/cm3) Pembahasan : Dik : m glukosa = 7,2 g C6H12O6 (180 g/mol) T = 3,21
= 3,21 K
C H2O = 4,2 JK-1g-1 Densitas air = 1 g/cm3 Dit : Hc glukosa = …..? Jawab : C6H12O6 + 6O2
6CO2(g) + 6H2O(l)
7,2 g glukosa =
= 0,04 mol
qp = m . C . T = 1000 cm3 .
.
.
3,21 K
= 13.482 J = 13,482 kJ Hc glukosa = (1mol/0,04 mol) . 13,482 kJ = 25
13,482 kJ
= 337,05 kJ/mol = -337,05 kJ/mol 3. Entalpi pemabakaran fruktosa, C6H12O6 (M=180 g/mol) adalah -2812 kJ/mol. Bila 1 buah apel yang beratnya 120 g, rata-rata mengandung 15%(berat) fruktosa. Tentukan jumlah kalor yang dapat dihasilkan oleh 5 buah apel! Pembahasan : Dik : C6H12O6 CM = 180 g/mol Hc C6H12O6 = -2.812 kJ/mol 1 buah apel = 120 g terdapat 15% fruktosa Dit : Q 5 buah apel = ……? Jawab : Dalam 1 buah apel yang neniliki berat 120 g mengandung 15% fruktosa. Berat fruktosa = 120 15% = 18 g Terdapat 5 buah apel Berat fruktosa dalam 5 apel = 18 g mol fruktosa = n = Hc = n
Q
=
5 = 90 g
= 0,5 mol
-2.812 kJ/mol = -2.812 kJ/mol = 2 Q= Q = -1.406 kJ
Q Q
7. tetapan laju untuk reaksi kedua, reaksi: 2NOBr(g) .
. Pada suhu 10
2NO(g) +
(g) adalah 0,80
. Jika dimulai dengan konsentrasi NOBr sebesar 0,086 M.
hitunglah Konstrasi NOBr sesudah 22 detik Penyelesaian:
lnAt = -17,6 . 0,086 lnAt = -1,51366 lnAt = ln -1,51366 At = 0,4144 M 8. Energi pengaktifan (Ea) untuk isomerisasi siklopropana menjadi propilena, merupakan reaksi orde satu, adalah 272
. pada 50
, tetapan laju reaksi adalah 6,1 x
Pertanyaan: a) Hitung Faktor A (tetapan Arrhenius) untuk reaksi ini: ln k = ln A -
ln
.
b) Hitung Tetapan laju untuk reaksi 25 50 25
=
L.
9. tetapan laju untuk reaksi orde kedua: 2 pada 300 konsentrasi
(g)
2NO(g) +
(g) adalah 0,54
. Berapa lama waktu (dalam detik)yang diperlukan agar
turun dari 0,62 M menjadi 0,28 M.
Penyelesaian: 2
(g)
2NO(g) +
(g)
ln 0,4516 = - 0,54 . t - 0,7949 = - 0,54 . t t = 1,4720 s 10. perhatikan tahap elementer berikut: X + 2Y a. Tuliskan hukum laju reaksi ini. b. Jika laju awal Pembentukan
adalah 3,8 x
M.
dan konsentrasi awal
X dan Y masing masing adalah 0,26 M dan 0,88 M. tentukan tetapan laju reaksinya.
k = 18,9 x
11. perhatikan reaksi berikut: X + Y
XY
Jika X dan Y direaksikan dengan perbandingan mol yang sama, maka setelah reaksi berlangsung 1 jam, sebanyak 75% zat X telah bereaksi. Jika reaksi berorde nol tehadap zat Y dan berorde satu terhadap X, maka tentukan nilai k. Penyelesaian:
1 = 1500 k k=
12. Dalam mengkaji reaksi piridina
M.
dengan metil iodide
dalam larutan
Benzena, berikut ini adalah dat laju reaksi awal yang diukur pada suhu 25
untuk
berbagai konsentrasi awal dari dua reaktan Laju (M. 1,00 x
1,00 x
7,5 x
2,00 x
2,00 x
3,0 x
2,00 x
4,00 x
6,0 x
)
Pertanyaan: a. Tuliskan hukum laju reaksi tersebut. b. Hitunglah tetapan laju dan berikan satuannya
c. Ramalkan laju reaksi awal untuk larutan dengan 2,0 x
M. :
= 5,0 x
M dan
=
13 Menurut perkiraan dalam setiap kenaikan suhu sebesar 10 oC, laju reaksi akan meningkat dua kali. Jika suatu reaksi berlangsung pada suhu t oC, suatu reaksi berlangsung selama 12 menit. Hitung waktu yang dibutuhkan reaksi tersebut jika suhunya diubah menjadi (t+30)OC. JAWAB : DIK: n = 2 i = 10oC T1= toC t 1= 12 menit T2 = 30OC DIT: t2=….? PENYE: ∆T = t + 30 – t t 1/t 2 12/t 2 12/t 2 12/t 2 8t2 t2 t2 t2
= n(∆T/i) = 2(30/10) = 23 =8 = 12 = 12/8 = 1,5 menit = 90 detik
1. Salah satu tokoh yang dikenal dalam perkembangn senyawa organik adalah Friedhrich Wohler. Jelaskan penemuan Friedrich Wohler dalam perkembangan kimia orgnik. Jawab : pada tahun 1828 wohler mendapat hasil yang tak disangka saat mencoba mengkristalisasi garam anorganik NH4CNO dari larutannya, iya tidak sengaja memproduksi senyawa organik yang telah diketahui yaitu urea, senyawa dari air seni.
2. Mengapa sampai saat ini istilah senyawa organik dan anorganik masih dipertahankan, walaupun pada hakikinya tidak ada perbedaannya. Jawan : karena dengan menggunakan istilah senyawa organik dan senyawa anorganik hal ini dapat untuk membedakan semua senyawa yang berasal dari mineral.
3. Deskripsikan perbedaan zat organik dan anorganik Jawab : zat organik adalah zat yang kebanyakan berasal dari makhluk hidup, yang senyawanya mudah terbakar, memiliki struktur yang rumit, yang mengandung unsur karbon, dan hanya dapat larut dalam pelarut organik contohnya CH4, C2H5OH, C2H6 dsb, sedangkan senyawa anorganik yaitu senyawa yang berasal dari alam mineral ( bukan makhluk hidup ), tidak mudah terbakar, sturktur sederhana, tidak semua senyawa anorganik memiliki unsur karbon, dan dapat larut dalam pelarut air atau organik contohnya NaF, NaCl, NaBr, Nal dsb. 4. Tuliskan skematik pembagian hidrokarbon Jawab : HIDROKARKON
ALIFATIK
JENUH ALKANA
SIKLIK
TIDAK JENUH
5. Jelaskan mengapa senyawa organik berikatan dengan ikatan kovalen bukan dengan ikatan ion. ALKENA
ALKUNA
ALISIKLIK
AROMATIK
Jawab: Kedua buah atom yang tergabung didalam ikatan ion memiliki perbedaan elektronegativitas yang besar, dimana ikatan ion sendiri menghasilkan ion positif dan juga ion negatif yang berpisah. Adapun muatan ion tersebut biasanya berkisar antara -3 elektro sampai dengan +3 elektron. Pada umumnya ikatan ion terjadi pada atom-atom dengan energi ionisasi paling rendah dengan atom-atom dengan afinitas elektron besar. Berbeda dengan ikatan kovalen yang mana atom-atom yang berikatan dalam ikatan tersebut memiliki perbedaan elektronegativitas (positif dan negatif) yang sangat kecil bahkan hampir tidak ada. Ikatan kovalen umumnya terdapat dalam sebagian besar ikatan dalam senyawa organik. 6. Gambarkan struktur senyawa 2 metil pentana dengan benar berdasarkan cara penentuan struktur senyawa organik. Jawab:
7. Tentukan nama struktur senyawa di bawah ini berdasarkan tahapan pemberian nama senyawa organik Cl
H3C-CH-CH-CH2-CH3
Br Jawab: 2-Bromo-3-Kloro-Pentana
8. Gambarkan struktur senyawa 1,3-dimetil sikloheksana dengan benar berdasarkan cara penentuan struktur senyawa organik. Jawab:
CH3
CH3
9. Tuliskan 5 sifat alkana yang anda ketahui. Jawab: 1) Merupakan senyawa nonpolar, sehingga tidak larut dalam air. 2) Pada suhu kamar, alkana dengan atom C1-C4 berfase gas, C5-C17 berfase cair dan > C18 berfase padat. 3) Bila rantai C semakin panjang viskositas ( kekentalan) semakin tinggi,titik didih semakin tinggi.
4) Untuk alkana yang berisomer , dengan atom C sama banyak, semakin banyak jumlah cabang semakin rendah titik didihnya. 5) Alkana dapat bereaksi dengan oksigen melalui reaksi pembakaran. 10. Tuliskan 5 kegunaan senyawa alkana yang anda ketahui. Jawab: 1. Metana; berguna sebagai bahan bakar untuk memasak, dan bahan baku pembuatanzat kimia seperti H2 dan NH3. 2. Etana; berguna sebagai bahan bakar untuk memasak dan sebagai refrigerant dalam sistem pendinginan dua tahap untuk suhu rendah. 3. Propana; merupakan komponen utama gas elpiji untuk memasak dan bahan baku senyawa organik. 4. Butana; berguna sebagai bahan bakar kendaraan dan bahan baku karet sintesis. 5. Oktana; merupakan komponen utama bahan bakar kendaraan bermotor, yaitu bensin. 11. Salah satu Reaksi senyawa alkana yang anda diketahui radial bebas. Tuliskan semua kemungkinan reaksi yang terjadi pada reaksi C2H6 +Cl2 C₂H₆ + Cl₂ → C₂H₅Cl + HCl etana + klorin → etil klorida + asam klorida
H
H
H H
|
|
|
|
H - C - C - H + Cl - Cl → H - C - C - Cl + H - Cl |
|
|
|
H
H
H H
Reaksi dari senyawa hidrokarbon alkana dengan unsur-unsur halogen disebut reaksi halogenasi. Reaksi ini akan menghasilkan senyawa alkil halida. Atom hidrogen dari alkana akan disubstitusi oleh halogen sehingga reaksi ini dapat disebut sebagai reaksi substitusi. 12. Mengapa alkena bercabang memiliki titik didih yang lebih rendah dibandingkan dengan alkena rangkai lurus dengan jumlah atom C yang sama. Jawab : Dengan adanya percabangan pada struktur alkana, maka bentuk molekul alkena cenderung menyerupai bentuk bola/bulat. Akibatnya luas permukaan bidang singgung antar molekul menjadi berkurang atau interaksi yang terjadi antar molekul menjadi berkurang sehingga gaya tarik antar molekulnya rendah. Dan untuk mengalahkan gaya tersebut hanya diperlukan energi yang dapat dicapai pada suhu rendah. 13. Tuliskan 5 senyawa alkena dan kegunaannya dalam kehidupan Jawab :
Etena digunakan sebagai bahan baku pembuatan polietena
Etena juga digunakan sebagai bahan baku pembuatan senyawa organik intermediet seperti kloroetena dan stirena
Propena digunakan sebagai bahan baku pembuatan polipropena. Polipropena merupakan polimer untuk membuat serat sintetis, materi pengepakan, dan peralatan masak.
Butadiena digunakan sebagai bahan baku pembuatan polibutadiena (karet sintetis)
Alkena suku rendah (etena, propena, dan butena) digunakan sebagai bahan baku pembuatan alkohol.
14. Karbit dapat digunakan untuk mengelas a. Mengapa karbit dapat digunakan untuk mengelas jawab: 1. Peralatan relatif murah dan memerlukan pemeliharaan minimal/sedikit, 2. Cara penggunaannya sangat mudah, tidak memerlukan teknik-teknik pengelasanyang tinggi
3. sehingga mudah untuk dipelajari, 4. Mudah dibawa dan dapat digunakan di lapangan maupun di pabrik atau dibengkelbengkel 5. karena peralatannya kecil dan sederhana, 6. Dengan teknik pengelasan yang tepat hampir semua jenis logam dapat dilas danalat ini 7. dapat digunakan untuk pemotongan maupun penyambungan
b. Tuliskan reaksi karbit dengan air jawab: CaC2 + 2 H2O → C2H2 + Ca(OH)2 15. Jelaskan Perbedaan alcohol primer dan alcohol sekunder dan berikan contohnya 1) Alkohol primer adalah alkohol dengan gugus –OH terikat pada atom C primer. Contoh :
CH3–CH2–CH2–CH2–OH butanol
CH3–CH2–CH2–OH propanol
2) Alkohol sekunder adalah alkohol dengan gugus –OH terikat pada atom C sekunder. Contoh : Gugus –OH selalu diikat oleh CH. Oleh karena itu, secara umum rumus struktur dari alkohol sekunder adalah seperti berikut.
16. Tuliskan 5 senyawa alcohol dan kegunaannya dalam kehidupan. Jawab :
1. Sebagai komponen aktif dalam minuman bir, anggur dan wiski 2. Etanol dengan kadar 70% digunakan sebagai zat antiseptik 3. Sebagai bahan baku pembuatan senyawa aldehida dan keton 4. Metanol digunakan sebagai campuran bahan bakar spirtus 5. Sebagai pelarut polar 17.
Berdasarkan rumus molekul dan rumus strukturnya apa persamaan dan perbedaan
alcohol dan eter.
Jawab : Alkohol dan eter disebut pasangan isomer fungsi , karena kedua senyawa tersebut memiliki rumus molekul sama tetapi gugus fungsinya berbeda . Karena gugus fungsi alkohol dan eter berbeda maka sifat-sifat alkohol dan eter berbeda sekali . Perbedaan alcohol dengan eter sebagai berikut :
Zat cair jernih ,mudah larut dalam air . Zat cair jernih , sukar larut dalam air.
Titik didih alcohol lebih tinggi ( bila Mr senyawanya sama ) Titik didih eter lebih rendah ( bila Mr senyawanya sama )
Akohol bereaksi dengan logam aktif ( Na atau K ) membebaskan gas H2 Eter tidak bereaksi dengan logam aktif ( Na atau K )
Akohol bereaksi dengan PCl5 membebaskan uap HCl Eter bereaksi dengan PCl5 tetapi tidak membebaskan uap HCl.
18. Tuliskan 3 kegunaan senyawa eter dalam kehidupan Jawab : Kegunaan senyawa eter dalam kehidupan yaitu sebagai berikut :
Eter digunakan sebagai pelarut senyawa karbon,
Dietil eter digunakan sebagai obat bius pada operasi,
Sebagai anti septik untuk mencegah infeksi,
Metil ters-butil eter (MTBE) digunaka unutuk menaikkan angka oktan bensin.
19.
Berdasarkan rumus struktur dan rumus molekulnya apa persamaan dan perbedaan
aldehid dan keton Jawab : Perbedaan Gugu karbonil aldehid terikat pada hidrogen dari satu ujung, tetapi dalam keton, gugus karbonil terikat pada atom karbon dari kedua belah pihak.aldehid. Oleh karena itu, gugus fungsional keton selalu terlihat di tengah molekul, dan gugus aldehid selalu di ujung. Dalam nomenklatur tersebut, aldehid memiliki akhiran -al dan keton akhiran adalah -on.keton Dalam molekul dimana aldehid adalah gugus fungsional, karbon karbonil diberikan nomor satu pada nomenklatur. Dalam keton, rantai diberi nomor dengan cara memberikan nomor serendah mungkin pada karbon karbonil (tidak akan mendapatkan nomor satu di setiap kesempatan).Aldehid dapat dengan mudah teroksidasi dibandingkan dengan keton. Persamaan Aldehid dan keton merupakan kelompok senyawa organic yang mengandung gugus karbonil. Aldehid dikenal dengan rumus RCHO, sedangkan suatu keton mempunyai dua gugus alkil yang terikat pada karbon karbonil dengan rumus RCOR.
20. Tuliskan kegunaan senyawa aldehida dalam kehidupan Jawab :
Kegunaan senyawa aldehida dalam kehidupan sehari-hari yaitu sebagai berikut :
Formaldehida (metanal) digunakan sebagai pembunuh kuman dan mengawetkan.
Formaldehida digunakan untuk membuat plastik termoset (plastic tahan panas).
Paraldehida digunakan sebagai akselerator vulkanisasi karet
21. Tuliskan kegunaan senyawa keton dalam kehidupan Jawab :
Kegunaan senyawa keton dalam kehidupan sehari-hari yaitu sebagai berikut :
Pelarut senyawa karbon, misalnya sebagai pembersih cat kuku.
Bahan baku pembuatan zat organic lain seperti chlaroform yang digunakan sebagai obat bius.
Selain aseton beberapa senyawa keton banyak yang berbau harum sehingga digunakan sebagai campuran parfum dan kosmetika lainnya.
22. Berdasarkan rumus molekul dan rumus strukturnya apa persamaan dan perbedaan karboksilat dan ester Jawab : Perbedaan 1. Asam karboksilat memiliki titik didih yang lebih tinggi dibandingkan ester karena terdapat ikatan hidrogen. 2. Beberapa asam karboksilat tidak berbau atau memiliki bau yang sedikit menyengat sedangkan ester memiliki aroma yang harum sehingga digunakan sebagai essens pada makanan. 3. Asam karboksilat bereaksi dengan basa kuat menghasilkan garam dan air. {R-COOH + NaOH ------> R-COO-Na + H2O} Ester bereaksi dengan basa kuat menghasilkan garam dan alkohol. {R-COO-R ' + NaOH -----> R-COO-Na + R'-OH}. 4. Asam karboksilat bereaksi dengan alkohol membentuk ester dan air disebut reaksi esterifikasi sedangkan reaksi ester dengan air menghasilkan asam karboksilat dan alkohol disebut reaksi hidrolisis. Persamaan 1. Asam karboksilat dan ester termasuk senyawa turunan alkana 2. Keduanya merupakan isomer fungsi karena memiliki rumus umum yang sama yaitu CnH2nO2
3. Ester atau alkil alkanoat merupakan senyawa turunan dari asam karboksilat. Ester dapat diperoleh dari reaksi antara asam karboksilat dan alkohol yang disebut esterifikasi. Atom H pada gugus -COOH digantikan gugus alkil R- dari alkohol. Persamaan reaksinya yaitu : R-OH + R-COOH ---------> R-COOR + H2O 23. Tuliskan kegunaan senyawa asam karboksilat dalam kehidupan! Jawab : asam asetat dalam pembuatan cuka Garam natrium sebagai pengawet Asam asetat dalam pembuatan karet Asam organik sebagai bahan pewarna
24. Tuliskan kegunaan senyawa ester dalam kehidupan! Jawab : Sebagai pengharum Bahan pembuatan lilin Obat penghilang rasa sakit Pembuatan cat dan lem
25. Apa yang dimaksud dengan A. Isomer rantai B. Isomer fungsional C. Isomer geometri D. Isomer optik Jawab :
Isomer rantai adalah jika senyawa-senyawa organik mempuyai rumus molekul yang sama tetapi urutan atom-atom penyusun senyawa tersebut berbeda karena terbentuknyacabang-cabang pada rantai lurus atau bergesernya ikatan rangkap atau bergesernya gugus fungsi dalam sebuah molekul.
Isomer fungsional adalah senyawa yang mempunyai rumus molekul sama tetapi mempunyai rumus struktur berbeda karena perbedaan gugus fungsional yang terikat pada senyawa tersebut.
Isomer geometri adalah senyawa-senyawa yang mempunyai rumus molekul sama namun memiliki struktur ruang yang berbeda.
Isomer optik adalah salah satu isomer konfigurasi yang mampu memutar bidang cahaya terpolarisasi searah atau berlawanan arah jarum jam.
26. Tuliskan semua kemungkinan isomer pentana (C5H12) ! Jawab : A. Isomer rantai lurus CH3-CH2-CH2-CH2-CH3 = n-pentana B. CH3-CH-CH2-CH3 = 2-metil-butana | CH3 C.
CH3 |
CH3-C-CH3 = 2,2-dimetil-propana | CH3 27. Mengapa senyawa kedua senyawa dibawah ini berisomer! CH3-CH=CH-CH3 (2-butena)
CH2=C-CH3 (2-metil propena) | CH3
Jawab : karena kedua senyawa ini memiliki rumus molekul yang sama yaitu C4H8 28. Tuliskan semua kemungkinan isomer dari pentanol Jawab :
A. n-pentanol = CH3-CH2-CH2-CH2-CH2-OH B. 2-pentanol= CH3-CH2-CH2-CH-CH3 | OH C. 3-pentanol= CH3-CH2-CH-CH2-CH3 | OH D. 2-metil-1-butanol = CH3-CH2-CH-CH2-OH | CH3 E. 3-metil-1-butanol = CH3-CH-CH2-CH2-OH | CH3 F. 2,2-dimetil-propanol
=
OH |
CH3-CH2-C-CH3 | CH3 G. 1,2-dimetil-propanol
= CH3-CH-CH-CH3 | | CH3 OH
29. Tuliskan struktur senyawa dengan nama 5,6,6,7-heksan-metil-3-oktena! Jawab : C6H14
CH3
|
|
CH3-CH2-CH2-CH2-CH=CH-CH2-CH3 |
|
|
C6H14 C6H14 C6H14 30. Apa perbedaan rumus struktur senyawa cis dan trans pada senyawa alkena. Jawab:
Molekul di mana dua atom yang samaberada di sisi yang sama dari ikatan rangkap dikenal sebagai isomer cis. Molekul dengan dua atom yang sama di sisi berlawanan dari ikatan rangkap dikenal sebagai isomer Trans. Isomer Cis bersifat polar, dan isomer Trans relatif non polar. Isomer cis memiliki titik didih yang lebih tinggi dibandingkan dengan isomer trans. isomer Trans memilikititiklebur yang lebihtinggi; Sebaliknya, molekul cis memiliki titik lebur yang lebih rendah. molekul Trans dikemas baik daripada molekul cis. Struktursenyawa cis dan trans
31. Apa yang dimaksud dengan atom C asimetris dan tuliskan contohnya. Jawab: Atom C asimetris adalah atom C yang keempat valensinya mengikat atom atau gugus atom yang berbeda. Sifat optis aktif ditunjukkan oleh senyawa yang mempunyai atom C asimetris. Contoh atom C asimetris adalah pada senyawa 1,2 propandiol yang mempunyai rumus struktur CH3-C*HOH-CH2OH yang mana atom C* mengikat: Satu CH3, Satu H, Satu OH, Satu CH2OH. 32. Apa perbedaan isomer levodan isomer dektro serta berikan contohnya. A. Isomer dekstro (d), yaitu senyawa yang arah pemutarannya ke kanan (sesuai dengan arah jarum jam), dan sudutnya berharga positif. B. Isomer levo (l), yaitu senyawa yang arah pemutarannya ke kiri (berlawanan dengan arah jarum jam), dan sudutnya berharga negatif. Dengan demikian ada dua macam senyawa 2- butanol, yaitu a. d-2-butanol, dengan sudut pemutaran = + 13,52 b. l-2-butanol, dengan sudut pemutaran = - 13,52 33. Tuliskan gugus pengarah orto dan para serta pengarah meta pada disubstitusi senyawa aromatis. a. Gugus pengarah orto dan para Yang dimaksud gugus pengarah orto-para adalah gugus substituen yang menyebabkan arah utama serangan elektrofil pada posisiortodan/ atau para terhadapkedudukangugussubstituentersebut. Guguspadacincinakanmengarahkansubstituen yang barumasukpadaposisiorto, para atau meta sesuaidengangugusmulanya. Gugusmulatersebut yang disebutsebagaipenentuorientasi. Gugus yang merupakan activator kuatadalahguguspengarahorto, para
(adisielektrofilikmengambiltempatpadaposisiortodan para bergantungpada activator).
Orientasiiniterutamadisebabkanolehkemampuansubstituenpengaktifkuatuntukmele paskanelektron (gugus amino dangugushidoksilmerupakangugus activator yang baik). Guguspengarahorto, para padaumumnyamemasukelektronkecincindandengandemikianmerupakanpengaktifc incin. Pada halogen (F, Cl, Br, dan I) keduaefek yang berlawananinimengakibatkanpengecualianpadaaturantersebut. Karenabersifatsebagaipenarikelektronkuat, halogen merupakanpendeaktifcincin, namunkarenaadanyapasanganelektronbebas, makahalogen ialahpengarahorto, para. b. Guguspengarah meta Guguspengarah meta adalahgugussubstituen yang menyebabkanarahutamaseranganelektrofilpadaposisi meta terhadapkedudukangugussubstituentersebut. Dalamsemuaguguspengarah meta, atom berhubungandengancincinmembawamuatanpositifpenuhatauparsialdandengandem ikianakanmenarikelektrondaricincin. Semuapengarah meta dengandemikianjugamerupakanguguspendeaktifcincin. Suatupengarah meta mempunyai atom bermuatanpositifatausebagianpositif yang terikatpadacincinbenzena. Dalamreaksinitrobenzena, gugusnitronyatidakmenambahkesetabilanintermedietnya. Malahanintermedietsubstitusiorto, atau para dankeadaantransisinyakurangstabil (karena energy yang tinggi), karenasebuahstrukturresonansimengandungmuatanpositifpada atom berdekatan. Olehkarenaitu, substitusiterjadilebihbanyakpadatempat meta, sebabkeadaantransisidanintermediatnyapadatempat yang berdekatanmengandungmuatanpositif. 34. Tuliskanstruktur A. Orto dikloro benzene
B. Para etilfenol
Related Documents

Tugas Rutin Kimia
January 2021 0
Tugas Rutin Filsafat.docx
February 2021 0
Tugas Rutin Pengaran Perusahaan
March 2021 0
Tugas Pendahuluan Kimia Fisik
March 2021 0
Kimia
February 2021 3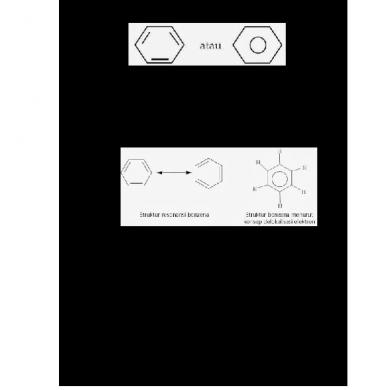
Makalah Kimia
January 2021 0More Documents from "Rifa'atul Mahmudah"

Tugas Rutin Kimia
January 2021 0
Schedule Preventive Maintenance Esm2.xlsx
January 2021 1
Sbmptn2018tpa998-5be103bb.pdf
March 2021 0
Alat Angkat
February 2021 0
Tugas 1 I Gusti Ayu Satriyaning (1506305081) Akl C1
January 2021 1